Kalsiumfosfat (Ca3 (PO4) 2) struktur, egenskaper, formasjon og bruk
den kalsiumfosfat er et uorganisk og tertiært salt hvis kjemiske formel er Ca3(PO4)2. Formelen sier at sammensetningen av dette salt er henholdsvis 3: 2 for kalsium og fosfat. Dette kan ses direkte i det nedre bildet, hvor Ca-kation er vist2+ og anionen PO43-. For hver tre Ca2+ Det er to PO43- samhandle med dem.
På den annen side refererer kalsiumfosfat til en rekke salter som varierer avhengig av Ca / P-forholdet, så vel som graden av hydrering og pH. Faktisk finnes det mange typer kalsiumfosfater som eksisterer og kan syntetiseres. Imidlertid refererer kalsiumfosfat bokstavelig talt til nomenklaturen bare til tricalcium, nevnte.

Alle kalsiumfosfater, inkludert Ca3(PO4)2, De er solide hvite med svake gråtoner. De kan være granulære, fine, krystallinske, og har partikkelstørrelser som er rundt mikrometer; og til og med er nanopartikler av disse fosfatene blitt fremstilt, med hvilke biokompatible materialer for beinene er utformet.
Denne biokompatibiliteten skyldes det faktum at disse saltene er funnet i tennene og kort sagt i beinvev av pattedyr. For eksempel er hydroksyapatitt et krystallinsk kalsiumfosfat, som i sin tur virker sammen med en amorf fase av det samme salt.
Dette betyr at amorfe og krystallinske kalsiumfosfater eksisterer. Av denne grunn er mangfold og flere alternativer ikke overraskende når man syntetiserer materialer basert på kalsiumfosfater; materialer i hvis egenskaper forskere er mer interessert hver dag over hele verden for å fokusere på restaurering av bein.
index
- 1 Struktur av kalsiumfosfat
- 1.1 Amorft kalsiumfosfat
- 1.2 Resten av familien
- 2 Fysiske og kjemiske egenskaper
- 2.1 navn
- 2,2 Molekylvekt
- 2.3 Fysisk beskrivelse
- 2.4 Smak
- 2,5 smeltepunkt
- 2.6 Løselighet
- 2,7 tetthet
- 2,8 brytningsindeks
- 2.9 Standard entalpi av trening
- 2.10 Lagringstemperatur
- 2,1 pH
- 3 trening
- 3.1 Kalsiumnitrat og ammoniumhydrogenfosfat
- 3.2 Kalsiumhydroksyd og fosforsyre
- 4 bruksområder
- 4.1 i beinvevet
- 4,2 biokeramiske sementer
- 4.3 Leger
- 4.4 Andre
- 5 referanser
Struktur av kalsiumfosfat
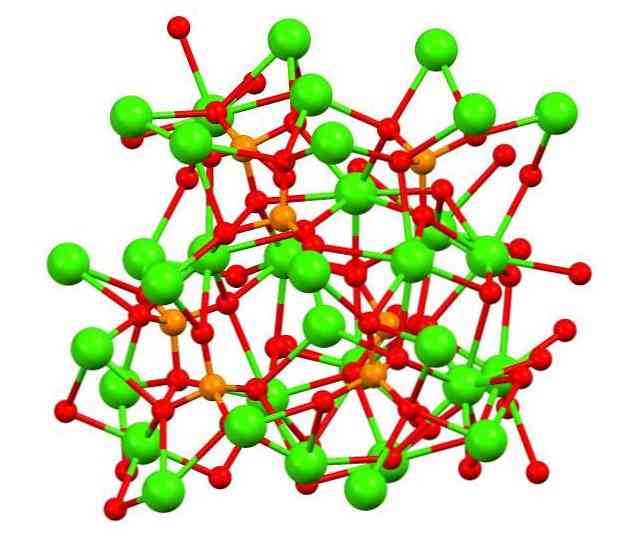
Det øvre bildet viser strukturen til tribasisk kalikafosfat i det merkelige whitlockit-mineral, som kan inneholde magnesium og jern som urenheter.
Selv om det ved første øyekast kan virke komplekst, er det nødvendig å klargjøre at modellen antar kovalente interaksjoner mellom fosfatatets oksygenatomer og kalsiummetallsentrene.
Som representasjon er det gyldig, men interaksjonene er elektrostatiske; det vil si kationer Ca2+ er tiltrukket av PO anioner43- (Ca2+- O-PO33-). Med dette i tankene er det forstått hvorfor i bildet kalsium (grønne sfærer) er omgitt av negativt ladede oksygenatomer (røde kuler).
Når det er så mange ioner, forlater det ikke et symmetrisk arrangement eller mønster synlig. Ca3(PO4)2 Vedtar ved lave temperaturer (T<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)2 (β-TCP, for sin akronym på engelsk).
Ved høye temperaturer blir den omdannet til polymorf-a-Ca3(PO4)2 (a-TCP), hvis enhetscelle tilsvarer et monoklinisk krystallinsk system. Ved enda høyere temperaturer kan polymorf α'-Ca også dannes3(PO4)2, som er av sekskantet krystallstruktur.
Amorf kalsiumfosfat
Krystallstrukturer har blitt nevnt for kalsiumfosfat, som kan forventes fra et salt. Imidlertid er det i stand til å utvise uorden og asymmetriske strukturer, knyttet mer til en type "kalsiumfosfatglass" enn til krystaller i streng forstand av dens definisjon.
Når dette skjer, sies det at kalsiumfosfat har en amorf struktur (ACP, amorf kalsiumfosfat). Flere forfattere peker på denne typen struktur som ansvarlig for de biologiske egenskapene til Ca3(PO4)2 i beinvev, er reparasjon og biomimetisering mulig.
Gjennom å forklare sin struktur ved atommagnetisk resonans (NMR), er nærværet av OH-ioner funnet- og HPO42- i AVS. Disse ionene dannes ved hydrolyse av et av fosfatene:
PO43- + H2O <=> HPO42- + OH-
Som et resultat blir den sanne strukturen av ACPen mer kompleks, hvis sammensetning av dets ioner er representert ved formelen: Ca9(PO4)6-x(HPO4)x(OH)x. 'X' indikerer graden av hydrering, siden hvis x = 1, ville formelen være som: Ca9(PO4)5(HPO4) (OH).
De forskjellige strukturer som PCA kan ha, avhenger av Ca / P molforholdene; det vil si av de relative mengder kalsium og fosfat, som forandrer all deres resulterende sammensetning.
Resten av familien
Kalsiumfosfater er faktisk en familie av uorganiske forbindelser, som i sin tur kan samhandle med en organisk matrise.
De andre fosfater oppnås "enkelt" ved å endre anioner som følger med kalsium (PO43-, HPO42-, H2PO4-, OH-), samt typen av urenheter i det faste stoffet. Således kan opptil elleve kalsiumfosfater eller mer, hver med sin egen struktur og egenskaper, oppstå naturlig eller kunstig..
Nedenfor er noen fosfater og deres respektive strukturer og kjemiske formler:
-Hydrogenkalsiumfosfatdihydrat, CaHPO4∙ 2H2O: monoklinisk.
-Kalsiumdihydrogenfosfatmonohydrat, Ca (H)2PO4)2∙ H2O: triclinic.
-Vannfritt diacidfosfat, Ca (H)2PO4)2: triclinic.
-Ocalciumhydrogenfosfat (OCP), Ca8H2(PO4)6: triclinic Det er en forløper i syntese av hydroksyapatitt.
-Hydroksyapatitt, Ca5(PO4)3OH: sekskantet.
Fysiske og kjemiske egenskaper
navnene
-Kalsiumfosfat
-Tricalciumfosfat
-Tricalciumdifosfat
Molekylvekt
310,74 g / mol.
Fysisk beskrivelse
Det er et luktfritt hvitt fast stoff.
smaken
smakløst.
Smeltepunkt
1670 ºK (1391 ºC).
løselighet
-Praktisk uoppløselig i vann.
-Uoppløselig i etanol.
-Oppløselig i fortynnet saltsyre og salpetersyre.
tetthet
3,14 g / cm3.
Brytningsindeks
1629
Standard entalpi av trening
4126 kcal / mol.
Lagringstemperatur
2-8 ºC.
pH-
6-8 i en vandig suspensjon av 50 g / l kalsiumfosfat.
trening
Kalsiumnitrat og hydrogenammoniumfosfat
Det finnes mange metoder for å produsere eller danne kalsiumfosfat. En av dem består av en blanding av to salter, Ca (NO)3)2∙ 4H2O, og (NH4)2HPO4, tidligere oppløst i absolutt alkohol og vann, henholdsvis. Ett salt gir kalsium, og det andre fosfatet.
Fra denne blandingen utfeller ACP, som deretter underkastes oppvarming i en ovn ved 800 ° C og i 2 timer. Som et resultat av denne prosedyre oppnås β-Ca3(PO4)2. Ved nøye å kontrollere temperaturer, agitasjon og kontakt tid, kan nanokrystalldannelse oppstå.
For å danne polymorf α-Ca3(PO4)2 det er nødvendig å oppvarme fosfat over 1000 ° C. Denne oppvarmingen utføres i nærvær av andre metallioner, som stabiliserer denne polymorfen tilstrekkelig for at den skal brukes ved romtemperatur; det vil si, det forblir i en stabil metastatistikk.
Kalsiumhydroksyd og fosforsyre
Kalsiumfosfat kan også dannes ved å blande oppløsningen av kalsiumhydroksyd og fosforsyre, med oppstart av syre-base nøytralisering. Etter en halv dag med modning i moderlutene, og deres riktige filtrering, vasking, tørking og sikting oppnås et granulært pulver av amorf fosfat, ACP.
Dette ACP-reaksjonsproduktet av høye temperaturer, transformerende i henhold til følgende kjemiske ligninger:
2ca9(HPO4) (PO4)5(OH) => 2Ca9(P2O7)0.5(PO4)5(OH) + H2O (ved T = 446,60 ° C)
2ca9(P2O7)0.5(PO4)5(OH) => 3Ca3(PO4)2 + 0,5H2O (ved T = 748,56 ° C)
På denne måten oppnås β-Ca3(PO4)2, dens mest vanlige og stabile polymorf.
søknader
I benvevet
Ca3(PO4)2 Det er den viktigste uorganiske bestanddelen av benaske. Det er en komponent i beinbyttertransplantasjoner, dette forklares av dens kjemiske likhet med mineraler som er tilstede i beinet.
Kalsiumfosfatbiomaterialer brukes til å korrigere beindefekter og i belegget av titanmetallproteser. Kalsiumfosfat blir avsatt på dem, isolerer dem fra miljøet og bremser titan korrosjonsprosessen.
Kalsiumfosfater, inkludert Ca3(PO4)2, De brukes til produksjon av keramiske materialer. Disse materialene er biokompatible og brukes for tiden til å gjenopprette alveolært bentap, som skyldes periodontal sykdom, endodontiske infeksjoner og andre forhold..
Imidlertid bør de bare brukes til å akselerere periapical beinreparasjon, i områder der det ikke er kronisk bakteriell infeksjon.
Kalsiumfosfat kan brukes til reparasjon av beindefekter, når det ikke er mulig å bruke et autogent bengraft. Det er mulig å bruke det alene eller i kombinasjon med en bionedbrytbar og resorberbar polymer, så som polyglykolsyre.
Bioceramiske sementer
Kalsiumfosfatcement (CPC) er et annet biokeramum som brukes til reparasjon av benvev. Den er laget ved å blande pulveret av forskjellige typer kalsiumfosfater med vann, og danner en pasta. Pastaen kan injiseres eller justeres til beindefekt eller hulrom.
Sementene er støpt, gradvis resorbert og erstattet av nydannet bein.
medisinsk
-Ca3(PO4)2 Det er et grunnleggende salt, så det brukes som antacida for å nøytralisere overflødig magesyre og øke pH. I tannkrem gir det en kilde til kalsium og fosfat for å lette prosessen med remineralisering av tennene og benhemostasen.
-Det brukes også som et kosttilskudd, selv om den billigste måten å erstatte kalsium er ved bruk av karbonat og sitrat..
-Kalsiumfosfat kan brukes til behandling av tetany, latent hypokalcemi og vedlikeholdsterapi. I tillegg er det nyttig i kalsiumtilskudd under graviditet og amming.
-Det brukes til behandling av forurensning med radioaktiv isotoperradio (Ra-226) og strontium (Sr-90). Kalsiumfosfat blokkerer absorpsjonen av radioaktive isotoper i fordøyelseskanalen, noe som begrenser skaden forårsaket av dem.
andre
-Kalsiumfosfat brukes som fôr til fugler. I tillegg er det brukt i toothpastes for å kontrollere tartar.
-Den brukes som et anti-kakemiddel, for eksempel for å forhindre at tabellsalt blir komprimert.
-Det virker som et blekemiddel for mel. Mens, i svin av svin forhindrer en uønsket farging og forbedrer tilstanden til steking.
referanser
- Tung M.S. (1998) Kalsiumfosfater: Struktur, sammensetning, oppløselighet og stabilitet. I: Amjad Z. (eds) Kalsiumfosfater i biologiske og industrielle systemer. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu og Honglian Dai. (2018). "Syntese, Karakterisering av Nano-P-Tricalciumfosfat og Inhibering på Hepatocellulære Karsinomceller," Journal of Nanomaterials, vol. 2018, artikkel-ID 7083416, 7 sider, 2018.
- Combes, Kristus og Rey, Christian. (2010). Amorf kalsiumfosfater: syntese, egenskaper og anvendelser i biomaterialer. Acta Biomaterialia, vol. 6 (nr 9). s. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Tricalciumfosfat. Hentet fra: en.wikipedia.org
- Abida et al. (2017). Tricalciumfosfatpulver: Fremstilling, karakterisering og komprimeringsevner. Mediterranean Journal of Chemistry 2017, 6 (3), 71-76.
- Pubchem. (2019). Kalsiumfosfat. Hentet fra: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Kalsiumfosfat. Science Direct. Hentet fra: sciencedirect.com


