Kalsiumhydrid (CaH2) egenskaper, reaktivitet og anvendelser
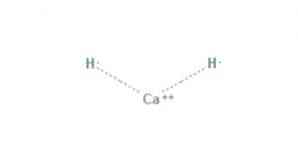
den kalsiumhydrid er en kjemisk forbindelse med formel CaH2, som gjør det til et jordalkalimidrid. Denne kjemiske forbindelsen har to ioniske bindinger mellom kalsium og de to hydridioner, som vist i figur 1.
Det er et saltvann hydrid, noe som betyr at strukturen er lik salt. Den krystallinske strukturen er den samme som for blyklorid (Cotunnite mineral) som vist i figur 2.

Alle alkaliske og jordalkalimetaller danner hydridsalter. I kjemien, er et hydrid anion hydrogen, H- eller, mer vanlig, er en forbindelse hvor ett eller flere hydrogenatomer har nukleofile sentre, redusere eller grunnleggende egenskaper.
I forbindelser som betraktes som hydrider, er hydrogenatomet koblet til et mer elektropositive element eller gruppe.
Den kan produseres ved å reagere kalsium og hydrogen ved en temperatur mellom 300 og 400 grader Celsius. En annen måte å tilberede kalsiumhydrid er å varme opp kalsiumkloridet sammen med hydrogen og natriummetall. Reaksjonen skjer som følger:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
I denne reaksjonen blir kalsium (Ca) og hydrogen (H) skaper et molekyl kalsiumhydrid mens natriumatomene med klormolekyler skape natriumklorid (NaCl).
Kalsiumhydrid kan også produseres ved å redusere kalsiumoksid (CaO) med magnesium (Mg). Reaksjonen utføres i nærvær av hydrogen. Denne reaksjonen produserer også magnesiumoksid (MgO). Nedenfor er formelen for denne kjemiske reaksjonen:
CaO + Mg + H2 → CaH2 + MgO
index
- 1 Fysiske og kjemiske egenskaper av kalsiumhydrid
- 2 Reaktivitet og farer
- 3 Håndtering og oppbevaring
- 4 bruksområder og applikasjoner
- 4.1 Tørkemiddel
- 4.2 Hydrogenproduksjon
- 4.3 Reduksjonsmiddel
- 5 Ulempe ved bruk av kalsiumhydrid
- 6 Referanser
Fysiske og kjemiske egenskaper av kalsiumhydrid
Kalsiumhydrid er et sett med krystaller med en hvit orthorhombisk struktur når den er ren. Vanligvis er det sjelden å finne det i dette skjemaet, så det har vanligvis en gråaktig nyanse. Det mangler en karakteristisk lukt. Utseendet er vist i figur 3 (Royal Society of Chemistry, 2015).

Den har en molekylvekt på 42,094 g / mol, har et smeltepunkt på 816 grader Celsius og en tetthet på 1,70 g / ml. Hvis det oppløses i vann reagerer det voldsomt som produserer hydrogen. Det reagerer også med alkohol (National Center for Biotechnology Information., S.F.).
Reaktivitet og farer
Kalsiumhydrid er en stabil kjemikalie, selv om den er svært reaktiv for vann eller fuktighet. Ved kontakt med vann frigjør det brennbare hydrogengasser som kan antennes spontant.
Det regnes som en eksplosiv forbindelse. Ved oppvarming i en reaksjon med tetrahydrofuran kan det forårsake eksplosjon. Når det blandes med klorat, hypoklorit, bromat, kaliumperklorat, blir følsom for varme, friksjon og er eksplosiv (kalsiumhydrid 7789-78-8, 2016).
Når sølvfluoridet knuses med kalsiumhydrid, blir massen glødende. Sterk oppvarming av hydridet med klor, brom eller jod fører til glødelighet.
Hydrid blandinger med forskjellige bromater, for eksempel barium bromat eller klorat, slik som barium klorat og perklorater som kalium perklorat, utnytte malingen. CaH2 reagerer glødeløst med sølvfluorid hvis det er fri for friksjon.
Denne forbindelsen må håndteres under en inert atmosfære. Hvis det ikke håndteres på riktig måte, kan det utgjøre en alvorlig trussel mot helse og sikkerhet for laboratoriepersonell, livreddere og kjemisk avfallshåndterer (UC-senter for laboratoriesikkerhet, 2013).
Ekstremt farlig ved kontakt med hud eller øyne, da det er irriterende. Meget farlig ved kontakt med huden fordi det kan være etsende.
Det er også farlig ved inntak og innånding. Mengden vevskader avhenger av kontaktens lengde. Kontakt med øynene kan føre til hornhinneskader eller blindhet.
Kontakt med huden kan forårsake betennelse og blærer. Innånding av støv vil gi irritasjon i mage-tarmkanalen eller luftveiene, kjennetegnet ved brennende, nysing og hoste..
Alvorlig overeksponering kan forårsake lungeskade, kvelning, bevisstløshet og til og med død. Betennelsen i øyet er preget av rødhet, irritasjon og kløe. Betennelse i huden er preget av kløe, peeling, rødhet eller noen ganger blærende.
Gjentatt eksponering av øynene til lavt nivå kan forårsake øyeirritasjon. Gjentatt eksponering for huden kan forårsake lokal hudutslettelse eller dermatitt.
Gjentatt innånding av støv kan forårsake varierende grad av åndedrettsirritasjon eller lungeskade. Gjentatt eller langvarig innånding av støv kan forårsake kronisk åndedrettsirritasjon (Sikkerhetsdatablad Kalsiumhydrid MSDS, 2005).
I tilfelle kontakt med øynene, skal de skylles straks med rikelig med vann i minst 15 minutter, og løft av og til øvre og nedre øyelokk.
Ved hudkontakt skal skylles straks med rikelig med vann i minst 15 minutter ved fjerning av forurenset klær og sko.
Ved inntak bør oppkast ikke fremkalles. Et giftkontrollsentral bør kalles. Det er tilrådelig å forlate utstillingsområdet og flytte til utendørs umiddelbart.
Ved innånding, hvis det er vanskelig å puste, er det nødvendig å tilveiebringe oksygen. Munn-til-munn pusting skal ikke gis dersom offeret inntok eller innåndet stoffet.
Kunstig åndedrettsvern skal induseres ved hjelp av en lommemaske utstyrt med en enveisventil eller annen egnet respiratorisk medisinsk anordning. I alle tilfeller må legen oppnås umiddelbart.
Håndtering og oppbevaring
Forbindelsen bør holdes i en tørr beholder bort fra varme. Det bør holdes vekk fra antennelseskilder. Unngå innånding av støv. Ingen vann skal legges til dette produktet
Ved utilstrekkelig ventilasjon, bruk egnet åndedrettsvern, for eksempel en filtermaske. Ved eksponering bør du søke lege og vise etiketten så mye som mulig. Unngå kontakt med hud og øyne.
Brannfarlige materialer, generelt, skal lagres i et separat sikkerhetsskap eller oppbevaringsrom. Hold beholderen tett lukket.
Oppbevares på et kjølig og godt ventilert sted. Alt utstyr som inneholder materiale for å unngå elektriske gnister må jordes. Beholderen skal holdes tørr og på et kjølig sted.
Det er et ikke-brennbart materiale. Brannmenn må imidlertid bruke passende utstyr mens slukking av brann rundt denne kjemiske forbindelsen.
Det er aldri tilrådelig å bruke vann for å slukke en brann rundt kalsiumhydrid. Tørr sand kan brukes, så vel som forbindelser som natriumklorid og natriumkarbonat til dette formål.
For å fjerne kalsiumhydridavfall må det dekomponeres ved å tilsette 25 ml metanol for hvert gram hydrid under en nitrogenatmosfære under omrøring.
Når reaksjonen er ferdig, tilsettes det samme volumet vann til den vandige kalsiummetoksydforbindelsen og slippes ut i avløpet med rikelig med vann (Nasjonalt forskningsråd, 1995)..
Bruk og applikasjoner
Desiccant agent
Kaliumhydrid er et relativt mildt tørkemiddel. På grunn av denne grunn er bruken av denne forbindelsen som et tørkemiddel sikrere sammenlignet med mer reaktive midler, så som natrium-kalium- og natriummetalllegeringer. Reagerer med vann på følgende måte:
CaH2 + 2 H20 → Ca (OH) 2 + 2 H2
Hydrolyseprodukter av denne reaksjon, hydrogen (gass) og Ca (OH) 2 (en vandig blanding) kan skilles fra kjemisk oppløsningsmiddel etter en filtrering, destillasjon eller dekantering.
Denne kjemiske forbindelsen er et effektivt tørkemiddel for mange grunnleggende løsningsmidler som aminer og pyridin. Noen ganger er det vant til å tørke løsemidler før du bruker mer reaktive tørkemidler.
Hydrogenproduksjon
På 1940-tallet var denne forbindelsen tilgjengelig som en kilde til hydrogen under handelsnavnet "Hydrolith".
Det har lenge vært brukt som kilde til hydrogen. Det brukes fremdeles til å produsere rent hydrogen i laboratorier for ulike eksperimenter, avanserte brenselceller og batteriforbruk (American Elements, S.F.).
Forbindelsen har blitt mye brukt i flere tiår som et trygt og praktisk middel for oppblåsning av værbobler.
På samme måte brukes det regelmessig i laboratorier for å produsere små mengder svært rent hydrogen for eksperimenter. Fuktighetsinnholdet i dieselbrensel beregnes av hydrogen utviklet etter behandling med CaH2.
Reduksjonsmiddel
Når oppvarmet til mellom 600 og 1000 grader Celsius, zirkoniumoksid, niob, uran, krom, titan, vanadium og tantal kan reduseres for å fremstille pulveret av disse metaller, så kalsiumhydrid kan bli brukt i metallurgien av støv.
Den følgende reaksjon illustrerer måten hvor kalsiumhydrid virker som et reduksjonsmiddel:
TiO + 2CaH2 → CaO + H2 + Ti
Ulempe ved bruk av kalsiumhydrid
Denne kjemiske forbindelsen er ofte det foretrukne valget som et tørkemiddel; Men det har også noen ulemper:
-Tørkningsvirkningen av denne forbindelsen er langsom, siden den ikke er løselig i et hvilket som helst løsningsmiddel som det ikke reagerer voldsomt på.
-Denne pulverforbindelsen er inkompatibel med mange oppløsningsmidler. Din reaksjon med klorkarboner kan til og med føre til eksplosjoner.
-Det kan ikke brukes til deoksygenererende løsningsmidler, siden det ikke er i stand til å eliminere oppløst oksygen.
-Differensiering mellom kalsiumhydrid og kalsiumhydroksyd er ganske vanskelig på grunn av dens lignende utseende.
referanser
- Amerikanske elementer. (S.F.). kalsiumhydrid. Hentet fra americanelements.com: americanelements.com.
- Kalsiumhydrid 7789-78-8. (2016). Hentet fra chemicalbook.com: chemicalbook.com.
- kalsiumhydrid. (N.d.). Hentet fra kjemi elev: chemistrylearner.com.
- Sikkerhetsdatablad Kalsiumhydrid MSDS. (2005, 10. oktober). Hentet fra sciencelab.com: sciencelab.com.
- Nasjonalt senter for bioteknologisk informasjon. (S.F.). PubChem Compound Database; CID = 105052. Hentet fra pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- nasjonalt forskningsråd. (1995). Forsiktig praksis i laboratoriet: Håndtering og avhending av kjemikalier. Washinton: NationalAcademy Press.
- Royal Society of Chemistry. (2015). kalsiumhydrid ID 94784. Hentet fra chemspider.com: chemspider.com.
- UC senter for laboratoriesikkerhet. (2013, 18. januar). standard operativ prosedyre kalsiumhydrid. Hentet fra chemengr.ucsb.edu: chemengr.ucsb.edu.


