Egenskaper for natriumhydrid (NaH), reaktivitet, farer og bruksområder
den natriumhydrid er en uorganisk forbindelse med formel NaH. Den har en ionisk binding mellom natrium og hydrid. Dets struktur er vist i figur 1 er representativ for saltvann hydrider, betydningen som er lik hydrid salt, bestående av Na + -ioner og H, i motsetning til de molekylære hydrider som boran, metan, ammoniakk og vann.
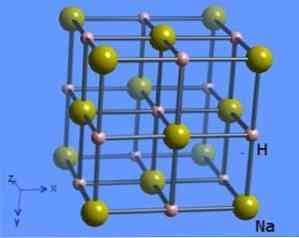
Krystallstrukturen har et koordinasjonstall 6, karakterisert ved at hvert molekyl er omgitt av natriumhydrid ioner 8 presenterer en oktaedrisk form og er illustrert i figur 2 (Mark Winter [The University of Sheffield Ltd og WebElements, 1993-2016).
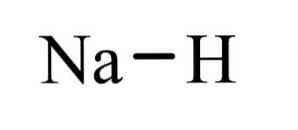
Forbindelsen fremstilles ved direkte reaksjon mellom natrium- og hydrogengass (natriumhydridformel - natriumhydridbruk, egenskaper, struktur og formel, 2005-2017) som følger:
H2 + 2Na → 2NaH
Natriumhydrid selges kommersielt som en 60% vekt / vekt dispersjonsform (vekt-for-vektprosent) i mineralolje for sikker håndtering (NATRIUMHYDRIDE, s.f.).
index
- 1 Fysiske og kjemiske egenskaper av natriumhydrid
- 2 Reaktivitet og farer
- 3 bruksområder
- 4 referanser
Fysiske og kjemiske egenskaper av natriumhydrid
Natriumhydrid er et hvitt fast stoff når det er rent, selv om det generelt er oppnådd i grått eller sølv. Utseendet er vist i figur 3.

NaH har en molekylvekt på 23,99771 g / mol, en densitet på 1,396 g / ml og et smeltepunkt på 800 ° C (Royal Society of Chemistry, 2015). Det er uoppløselig i ammoniakk, benzen, karbontetraklorid og karbondisulfid (National Center for Biotechnology Information, s.f.).
Forbindelsen er ekstremt ustabil. Ren NaH kan lett antennes i luften. Når det kommer i kontakt med vannet i luften, frigjør det svært brennbart hydrogen.
Når den er åpen for luft og fuktighet, blir NaH også lett hydrolysert i den sterke korrosive base av natriumhydroksyd (NaOH) i henhold til reaksjonen:
NaH + H20 → NaOH + H2
I denne reaksjonen kan det observeres at natriumhydrid oppfører seg som en base. Dette skyldes elektronegativitet.
Natrium har en elektronegativitet signifikant lavere (≈1,0) enn hydrogen (≈2,1), noe som betyr at hydrogen ekstrahert elektrontetthet mot seg selv og bort fra natrium for å fremstille et natrium- kation og et anion av hydrid.
For en forbindelse som er en Brønsted-syre, må den skille elektrondensiteten fra hydrogenet, det vil si koble den til et elektronegativt atom som oksygen, fluor, nitrogen, etc. Først da kan den formelt beskrives som H + og kan den bli dissociert som sådan.
Et hydrid er mye bedre beskrevet som H- og har et fritt par elektroner. Som sådan er det en Brønsted base, ikke en syre. Faktisk, hvis du utvider Brønsted-syre / basisdefinisjonen på samme måte som Lewis gjorde, vil du komme til den konklusjonen at natrium (Na +) er syreartene her.
Brønsted-syre / basereaksjonsproduktet av H-basen og H + syren blir H2. Fordi sur hydrogenet ekstraheres direkte fra vannet, kan hydrogengassen boble, forskyve likevekten selv om reaksjonen ikke er termodynamisk favorisert.
OH- ioner kan overlates som kan skrives med resten av Na + kation for å gi natriumhydroksid (Hvorfor er fast natriumhydrid basert og ikke sur når det reageres med vann?, 2016).
Reaktivitet og farer
Forbindelsen er et kraftig reduksjonsmiddel. Anfaller SiO2 i glass. Den antennes ved kontakt med gassformige F2, Cl2, Br2 og I2 (sistnevnte ved temperaturer over 100 ° C), spesielt i nærvær av fuktighet, for å danne HF, HCl, HBr og HI.
Reagerer med svovel for å gi Na2S og H2S. Det kan reagere eksplosivt med dimetylsulfoksid. Reagerer kraftig med acetylen, selv ved -60 ° C. Det er spontant brennbart i fluor.
Den initierer en polymerisasjonsreaksjon i etyl-2,2,3-trifluorpropionat, slik at esteren dekomponerer voldsomt. Nærværet i reaksjonen av dietylsuccinat og etyltrifluoracetat har forårsaket eksplosjoner (NATRIUMHYDRIDE, 2016).
Natriumhydrid anses å være etsende for huden eller øynene, på grunn av potensialet for kaustiske biprodukter av reaksjoner med vann.
I tilfelle kontakt med øynene, skal de skylles med store mengder vann under øyelokkene i minst 15 minutter og øyeblikkelig søk legehjelp..
Ved kontakt med huden, børst straks og skyll det berørte området med vann. Kontakt lege hvis irritasjon vedvarer.
Det er skadelig ved inntak på grunn av reaksjonen på vann. Ikke fremkall brekninger. Du bør øyeblikkelig søke lege og overføre offeret til et medisinsk senter.
Spredningen av natriumhydrid i olje er ikke støv. Materialet som reagerer, kan emittere en fin kaustisk tåke. Ved innånding skyll munnen med vann og overfør offeret til et sted med frisk luft. Medisinsk oppmerksomhet bør søkes (Rhom and Hass Inc., 2007).
søknader
Hovedanvendelsen til natriumhydrid er å utføre kondensasjons- og alkyleringsreaksjoner som utvikles gjennom dannelsen av et karbanion (katalysert av basen).
Natriumhydrid i olje ligner natriumalkoholater og natriummetall i sin evne til å fungere som et deprotoneringsmiddel i acetoeddiksyre-ester, Claisen-kondenseringer, Stobbe, Dieckmann og beslektede reaksjoner. Det har markert fordeler over andre kondensasjonsmidler ved at:
- Det er en sterkere base, noe som resulterer i en mer direkte deprotonering.
- Ingen overskudd er nødvendig.
- Den produserte H2 gir et mål på omfanget av reaksjonen.
- Sekundære reaksjoner som reduksjoner elimineres.
Alkyleringer av aromatiske og heterocykliske aminer, så som 2-aminopyridin og fenotiazin, oppnås lett ved høyt utbytte ved anvendelse av blandinger av toluen-metylformamid. Konsentrasjonen av dimetylformamid er en variabel som brukes til å kontrollere reaksjonshastigheten (HINCKLEY, 1957).
Det er blitt foreslått anvendelse av natriumhydrid for hydrogenlagring for bruk i brenselcellekjøretøy, idet hydrid hydrogeninnesluttet i plastgranuler blir findelt i nærvær av vann for å frigjøre.
referanser
- HINCKLEY, M. D. (1957). Fremstilling, håndtering og bruk av natriumhydrid. Fremskritt i kjemi, bind 19, 106-117.
- Mark Winter [University of Sheffield and WebElements Ltd, U. (1993-2016). Natrium: natriumhydrid. Hentet fra WebElements: webelements.com.
- Nasjonalt senter for bioteknologisk informasjon. (N.d.). PubChem Compound Database; CID = 24758. Hentet fra PubChem: pubchem.ncbi.nlm.nih.gov.
- Rhom og Hass inc. (2007, desember). Natriumhydrid 60% dispersjon i olje. Hentet fra dow.com.
- Royal Society of Chemistry. (2015). Natriumhydrid. Hentet fra ChemSpider: chemspider.com.
- NATRIUMHYDRID. (2016). Hentet fra cameokemikalier: cameochemicals.noaa.gov.
- Natriumhydrid Formel - Natriumhydrid Bruk, Egenskaper, Struktur og Formel. (2005-2017). Hentet fra Softschools.com: softschools.com.
- NATRIUMHYDRID. (N.d.). Hentet fra chemicalland21: chemicalland21.com.
- Hvorfor er fast natriumhydrid basert og ikke sur når det blir reagert med vann? (2016, 20. april). Hentet fra stackexchange: chemistry.stackexchange.com.


