Forseplingsreaksjon og stoffer som kan oppnås
den forsåpning Det er den grunnleggende hydrolysen av en ester. Dette betyr at esteren reagerer med en base (NaOH eller KOH) irreversibelt, og produserer alkohol og karboksylater av natrium eller kalium. Ordet betyr "produksjon av såper" og er faktisk en av de eldste kjemiske reaksjonene som brukes av menneskeheten.
I babylonske tider, med hjelp av asken samlet fra tre og planter og animalsk fett, perfeksjonerte de kunsten å lage såper. Hvorfor dyrefett? Årsaken er at den er rik på glyceroltriestere (triglyserider), og treaske er en kilde til kalium, grunnmetallet.
Ellers fortsetter reaksjonen til et lavere utbytte, men nok til å reflektere dets effekter på malene og noen overflater. Slik er tilfellet med oljemalerier, hvor pigmentene blandes med olje (esterkilde).
index
- 1 Forsåpningsreaksjon
- 1.1 Mekanisme
- 1.2 Kinetikk
- 2 Stoffer som kan oppnås ved forsapning
- 2.1 Oppløsningsvirkning av såper
- 3 referanser
Forsåpningsreaksjon
mekanisme
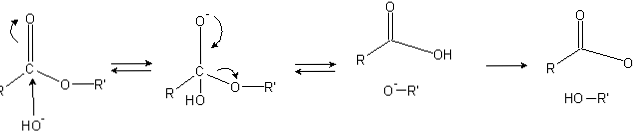
Estrene har en acylgruppe (O = C-R), som er utsatt for nukleofile angrep som OH-.
Fordi oksygenatomer "stjeler" elektronisk tetthet fra karbonatomet, er det delvis ladet, enda mer når det gjelder estere.
Følgelig tiltrekker denne positive ladningen negative arter som er i stand til å levere elektroner til karbonatomet, idet det nukleofile angrepet forekommer (venstre side av bildet). Som et resultat dannes et tetraederalt mellomprodukt (det andre molekylet fra venstre til høyre).
Den negative ladningen på oksygenet i det tetraedrale mellomproduktet er produktet av en OH- omkringliggende. Deretter blir denne negative ladningen utelatt for å oppstå karbonylgruppen, "tvinge" så å bryte C-OR'-bindingen. Dessuten produserer denne flyttingen en karboksylsyre RCOOH og et alkoksyd-ion R'O-.
Endelig, som reaksjonsmediet er grunnleggende, deprotonerer alkoksydet et molekyl vann og karboksylsyren reagerer med en annen OH- av mediet, genererer produkter av forsapning.
Kinetikken
Hastigheten til forsåpningsreaksjonen er proporsjonal med konsentrasjonene av reaktantene. Med andre ord, øker enten konsentrasjonen av esteren (RCOOR ') eller basen (NaOH), vil reaksjonen fortsette med en høyere hastighet.
Dette er også oversatt som følger: Forsåpningsgraden er første rekkefølge med hensyn til esteren, og første rekkefølge med hensyn til basen. Ovennevnte kan uttrykkes med følgende matematiske ligning:
Hastighet = k [RCOOR '] [NaOH]
Hvor k er konstant eller hastighetskoeffisienten, som varierer som en funksjon av temperatur eller trykk; det vil si jo høyere varmen er, desto større blir saponifiseringshastigheten. Av denne grunn er mediet underkastet koking.
Da begge reagensene er av første ordinær kinetisk, er den generelle reaksjonen andre rekkefølge.
I reaksjonsmekanismen for forsapning krever dannelsen av det tetraedrale mellomprodukt det nukleofile angrep, som involverer både esteren og basen.
Således reflekteres andreordskinetikk i dette faktum, fordi de intervenerer i det (sakte) determinantstrinnet i reaksjonen.
Stoffer som kan oppnås ved forsapning

De viktigste produktene av forsåpningen er alkoholer og salter av karboksylsyrer. I et surt medium oppnås de respektive RCOOH, oppnådd ved forsåpning av fett og oljer, som er kjent som fettsyrer..
På denne måten består såper av salter av fettsyrene som følge av forsapning. Går du ut med hvilke kationer? De kan være Na+, K+, mg2+, tro3+, etc.
Disse saltene er oppløselige i vann, men utfelles ved virkningen av NaCl tilsatt til blandingen, som dehydrerer såpen og separerer den fra den vandige fase. Forseglingsreaksjonen for et triglyserid er som følger:
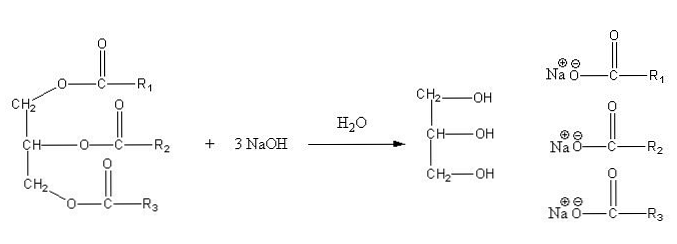
Glyserin er alkoholholdig "E", og såpe er alle saltene av de resulterende fettsyrene. Her har hver sidekjede -R forskjellige lengder og grad av umettethet. Følgelig gjør disse kjedene forskjellen mellom fett og vegetabilske oljer.
Nøkkelen til fremstilling av såper ligger da i valget av de beste fettene og oljene, eller mer spesifikt ved valg av forskjellige kilder til triglyserider.
Denne hvite såpemassen kan inneholde fargestoffer og andre organiske forbindelser i sin struktur, noe som gir behagelige aromaer og lyse farger. Herfra er rekkevidden av muligheter tamed av kunst og kall i denne handel.
Forseplingsreaksjonen er imidlertid også en syntetisk rute av karboksylsyrer og alkoholer som ikke nødvendigvis har å gjøre med glycerin eller såper.
For eksempel vil grunnleggende hydrolyse av en hvilken som helst ester, så som enkel etylacetat, produsere eddiksyre og etanol.
Løsemiddelverk av såper

Saltene av fettsyrene er oppløselige i vann, men ikke på samme måte som ioner er solvatisert; det er omgitt av en vandig sfære. Ved såper, hindrer sidekjedene deres -R i teorien fra å oppløse seg i vann.
For å motvirke denne energisk ubehagelige stillingen er de derfor orientert slik at disse kjedene kommer i kontakt, danner en apolar organisk kjerne, mens polarhoder, enden (-COO)- na+), samhandle med vannmolekyler og lage et "polar skall".
Ovenstående er illustrert på bildet over, hvor denne typen struktur kjent som micelle er vist.
De "svarte haler" korresponderer med de hydrofobe kjedene, blir viklet inn i en organisk kjerne beskyttet av de grå kulene. Disse grå kulene utgjør polarskjoldet, hodene -COO- na+.
Deretter er micellene klynger (klaser) av saltene av fettsyrene. Innenfor disse kan de omslutte fett, som er uoppløselig i vann på grunn av sin apolare karakter.
Hvordan gjør de det? Både fett- og R-kjedene er hydrofobe, så begge har stor affinitet for hverandre.
Når micellene innesluter fettene, samhandler vannet med polarskallet, slik at såpeløseligheten blir mulig. På samme måte er micellene negativt ladet, noe som forårsaker repulsjoner til hverandre og derfor genererer dispersjonen av fettet.
referanser
- Anne Marie Helmenstine, Ph.D. (3. oktober 2017). Forebygging Definisjon og Reaksjon. Hentet 24. april 2018, fra: thoughtco.com
- Francis A. Carey. Organisk kjemi Karboksylsyrer. (sjette utgave, s. 863-866). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organisk kjemi. Lipider (10. utgave., Side 1056-1058). Wiley Plus.
- Wikipedia. (2018). Forsåpning. Hentet 24. april 2018, fra: en.wikipedia.org
- Boyd C. (27. februar 2015). Forstå kjemi og historie av såpe. Hentet 24. april 2018, fra: chemservice.com
- Luca Laghi (27. mars 2007). Forsåpning. Hentet 24. april 2018, fra: commons.wikimedia.org
- Amanda Hekle (12. mai 2015). Micelle (gråtoner). Hentet 24. april 2018, fra: commons.wikimedia.org


