Histonas egenskaper, struktur, typer og funksjoner
den histoner er grunnleggende proteiner som interagerer med DNA for dannelse av nukleosomer, som utgjør kromatinstrengene som utgjør kromosomene i eukaryotiske organismer.
Nukleosomer, komplekser dannet av DNA og proteiner, ble oppdaget i 1974, og det er histonene som samler dette basale nivået av kromatinorganisasjon. Imidlertid er eksistensen av histonproteiner kjent siden før 1960-tallet.
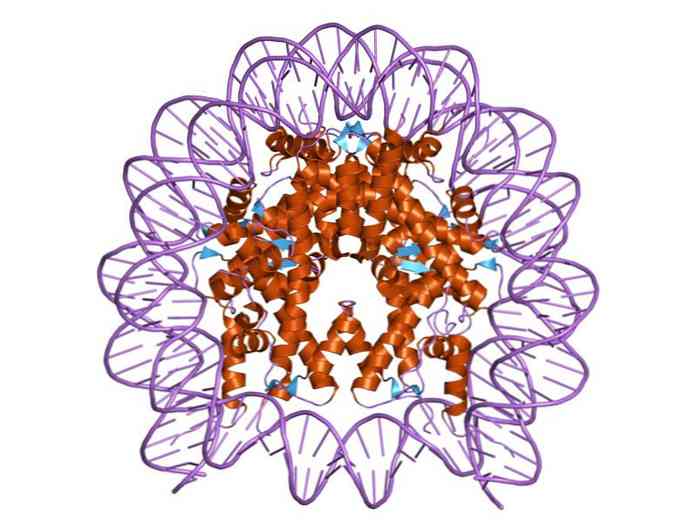
Histonene er organisert på en slik måte at DNA dobbeltbåndet pakkes rundt et proteinsenter som består av disse proteinene som samhandler tett med hverandre. Histonsenteret har en skiveform og DNA gir ca 1,7 omdreininger rundt det.
Flere hydrogenbindinger tillater binding av DNA til proteinsenteret dannet av histonene i hver nukleosom. Disse bindingene dannes hovedsakelig mellom aminosyreskjelettene av histoner og sukkerfosfat-ryggraden i DNA. Noen hydrofobe interaksjoner og ioniske bindinger deltar også.
Proteiner kjent som "kromatinremodellering komplekser", er ansvarlig for å bryte og bindingsdannelse mellom DNA-binding og histoner, slik at oppføring av transkripsjonsmaskineri til DNA som inneholdes i nukleosomene.
Til tross for tilgjengeligheten til nukleinsyrene til proteinet kjerne bestående av histoner, er disse anordnet slik at, om nødvendig, tillate oppføring av transkripsjonsfaktorer og andre relaterte til ekspresjonen eller genet Slå proteiner.
Histoner kan gjennomgå ulike modifikasjoner som genererer flere varianter, hvilket muliggjør eksistensen av mange forskjellige former for kromatin som har egenskapen til å modulere genuttrykk på forskjellige måter.
index
- 1 Egenskaper
- 2 struktur
- 2.1 Unionens histoner
- 3 typer
- 3.1 Nukleosomale histoner
- 3.2 Unionshistoner
- 4 funksjoner
- 5 referanser
funksjoner
De er de mest konserverte eukaryote proteiner i naturen. Det har blitt vist, for eksempel, at ertehiston H4 er forskjellig i bare to av de 102 aminosyreposisjonene av kuprotein H4.
Histoner er relativt små proteiner, med ikke mer enn 140 aminosyrer. De er rik på basiske aminosyrerester, slik at de har en netto positiv ladning, hvilket bidrar til deres interaksjon med nukleinsyre, negativt ladet, for å danne nukleosomene.
Nukleosomale og kryssende eller brodannede histoner er kjent. Nukleosomhistonene er H3, H4, H2A og H2B, mens bindingshistonene tilhører H1-histon-familien.
Under sammensetningen av nukleosomet blir de spesifikke dimerer H3-H4 og H2A-H2B opprinnelig dannet. To H3-H4 dimerer blir deretter sammenføyt til dannelse av tetramerer som deretter kombineres med H2A-H2B dimerer, danner det oktameriske senteret.
Alle histoner syntetiseres hovedsakelig under S-fasen av cellesyklusen, og nukleosomene settes sammen i de naserende DNA-helikopterene, like etter replikasjonsgaffelen..
struktur
Den generelle strukturen av histoner inkluderer en basisk aminosyreregion og et sterkt konservert globalt karboksylområde blant eukaryotiske organismer.
Et strukturelt motiv kjent som "histon fold", består av tre alfa-helikser og to åk er forbundet med danner en liten hydrofob sentrum, er ansvarlig for protein-protein interaksjoner mellom histoner som danner nucleosome.
Det er denne folden av histon som utgjør det globulære karbokseldomenet til nevnte nukleosomale proteiner i alle eukaryoter.
Histoner har også små "haler" eller aminoterminale og andre karboksylterminale regioner (tilgjengelige for proteaser) med høyst 40 aminosyrer. Begge regioner er rike på basale aminosyrer som kan gjennomgå flere post-translasjonelle kovalente modifikasjoner.
Unionens histoner
I eukaryoter er det to familier av histoner av union, differensiert av deres struktur. Noen har en tredelt konstruksjon, med den kuleformet domene som er beskrevet ovenfor flankert av N- og C-terminale områder "ustrukturert"; mens andre bare har et C-terminal domene.
Selv om de fleste histoner er konserverte, kan enkelte spesifikke varianter oppstå under embryogenese eller modning av spesialiserte celler i enkelte organismer. Noen strukturelle variasjoner har å gjøre med posttranslasjonelle modifikasjoner som følgende:
-fosforylering: Det antas å være relatert til modifikasjonen av graden av kondensasjon av kromatin og er vanligvis funnet i serinrester.
-acetylering: assosiert med kromosomale områder som er transkripsjonelt aktive. Det oppstår vanligvis i sidekjeder av lysinrester. Når det skjer på disse restene, reduseres den positive ladningen, noe som reduserer proteinets affinitet med DNA.
-metylering: kan gis som mono-, di- eller trimetilación av lysinrester som stikker ut fra proteinkjernen.
Spesifikke enzymer er ansvarlige for å lage disse kovalente modifikasjonene i histoner. Disse enzymene inkluderer histonacetyltransferaser (HATs), histon-deacetylase-komplekser (HDACs) og histon-metyltransferaser og demetylaser..
typen
Karakteriseringen av histonene har blitt utført ved ulike biokjemiske teknikker, blant annet kromatografer som er basert på svake kationbytterharpikser skiller seg ut.
Noen forfattere etablere en form for klassifisering i hvilken 5 hovedtyper av histoner i eukaryoter skiller: FI, 21 kDa protein; F2A1 eller FIV, med pluss eller minus 11,3 kDa; F2A2 eller FIIbI, 14,5 kDa; F2B eller FIIb2, med en molekylvekt på 13,7 kDa, og F3 eller FIII, 15,3 kDa.
Alle disse typer histoner, med unntak av FI-gruppen, finnes i ekvimolære mengder i cellene.
En annen klassifisering, med den samme kraft, og kanskje den mest brukte i dag, foreslås at det finnes to ulike typer av histoner, nemlig de som er en del av oktamer av nucleosome og histon binding eller bro, som forbinder nukleosomene mellom ja.
Enkelte varianter kan også forekomme mellom artene og i motsetning til kjerne histoner, skal varianter syntetisert under interfase og føres inn i den på forhånd dannede kromatin gjennom en prosess som er avhengig av energien som frigjøres fra ATP-hydrolyse.
Nukleosomale histoner
Kjernen til et nukleosom består av et par av hver av de fire konstitutive histonene: H2a, H2b, H3 og H4; over hvilke DNA-segmenter på ca. 145 basepar er innpakket.
Histonen H4 og H2B er i prinsippet uunngåelig. Noen variasjoner er imidlertid tydelige i histoner H3 og H2A, hvis biofysiske og biokjemiske egenskaper endrer nukleosoms normale natur..
En variant av histon H2A hos mennesker, H2A.Z-proteinet har en stor sur region og kan favorisere stabiliteten av nukleosomet, avhengig av histone H3-varianter som den er assosiert med.
Disse histonene viser noen variasjoner mellom arter, som er et spesielt tilfelle av histon H2B, for hvilken den første tredjedel av molekylet er svært variabel.
Unionens histoner
Koblings- eller brohistonene er histon i klasse H1. Disse er ansvarlige for foreningen mellom nukleosomer og DNA-beskyttelsen som stikker ut i begynnelsen og slutten av hver partikkel.
I motsetning til nukleosomale histoner har ikke alle histoner av type H1 den kuleformede regionen av "fold" av histoner. Disse proteinene binder til DNA mellom nukleosomer, forenkler en endring i balansen mellom kromatin og en mer kondensert og mindre aktiv tilstand, transkripsjonelt sett.
Studier har knyttet disse histonene med aldring, DNA-reparasjon og apoptotiske prosesser, så det antas at de har en avgjørende rolle i vedlikehold av genomisk integritet.
funksjoner
Alle aminosyrerester av histoner deltar på en eller annen måte i deres samspill med DNA, noe som forklarer at de er så bevart blant kongene i eukaryotiske organismer.
Deltagelse av histoner i DNA-emballasje i form av kromatin er svært relevant for komplekse flercellede organismer, hvor forskjellige cellelinjer kan spesial bare å endre tilgjengeligheten av deres gener til transkripsjonsmaskineri.
Transskripsjonelt aktive genomiske regioner er tette i nukleosomer, noe som tyder på at foreningen av DNA med histonproteiner er avgjørende for den negative eller positive reguleringen av deres transkripsjon.
På samme måte gjennom hele livet av en celle respons på mange stimuli, både interne og eksterne, det kommer an på små endringer i kromatin, som vanligvis har å gjøre med ombygging og posttranslational modifikasjon av histoner funnet i nært forhold til DNA.
Flere histon-variabler utøver forskjellige funksjoner i eukaryoter. En av dem har å gjøre med deltakelsen av en variant av histon H3 i dannelsen av sentromeriske strukturer som er ansvarlige for segregering av kromosomer under mitose.
Det er blitt vist at motstykket til dette proteinet i andre eukaryoter er avgjørende for den kinetochore protein sammenstillingen som spindel mikrotubuler binde i løpet av mitose og meiose.
referanser
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., & Walter, P. (2015). Molekylærbiologi av cellen (6. utgave). New York: Garland Science.
- Campos, E. I., & Reinberg, D. (2009). Histoner: Annotering av kromatin. Annu. Rev. Genet., 43, 559-599.
- Harvey, A.C., & Downs, J.A. (2004). Hvilke funksjoner gir linker histoner? Molekylær mikrobiologi, 53, 771-775.
- Henikoff, S., & Ahmad, K. (2005). Montering av varianthistoner i kromatin. Annu. Rev. Cell. Dev. Biol., 21, 133-153.
- Isenberg, I. (1979). Histoner. Annu. Rev. Biochem., 48, 159-191.
- Kornberg, R. D., og Thomas, J. O. (1974). Kromatinstruktur: Oligomerer av histonene. Science, 184 (4139), 865-868.
- Smith, E., DeLange, R., & Bonner, J. (1970). Kjemi og biologi av histonene. Fysiologiske vurderinger, 50 (2), 159-170.


