Karakteristiske egenskaper av materiell (fysisk og kjemisk)
den karakteristiske egenskaper av materie De er kjemiske eller fysiske egenskaper som kan hjelpe til med å identifisere eller skille et stoff fra en annen. Fysiske egenskaper er karakteristika av et stoff som observeres med sansene. Kjemiske egenskaper er egenskaper som beskriver hvordan et stoff forandrer seg fra ett stoff til et annet under en kjemisk reaksjon.
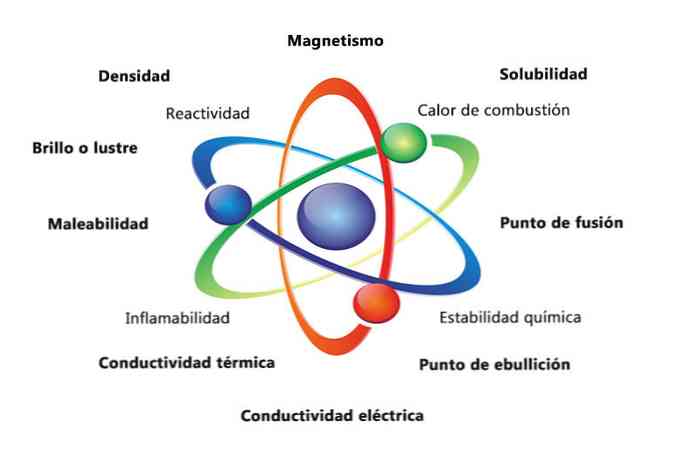
Noen fysiske egenskaper av et stoff er tetthet, oppløselighet, smeltepunkt, farge og masse. Materialets kjemiske egenskaper inkluderer brennbarhet, reaktivitet med syrer og korrosjon. Noen eksempler på hvordan stoffets egenskaper kan bidra til å identifisere et element, er å sammenligne tettheter av forskjellige elementer.
Et element som gull har en tetthet på 19,3 gram per kubikkcentimeter, mens tettheten av svovel er 1,96 gram per kubikkcentimeter. På samme måte er smeltepunktene av stoffer som vann og isopropylalkohol forskjellig.
Fysiske egenskaper av materie
Materielle fysiske egenskaper er egenskaper som kan måles eller observeres uten å endre stoffets kjemiske natur. Noen eksempler på fysiske egenskaper er:
- Tetthet: Mengden materie som har et objekt, beregnes ved å dele massen etter volum.
- Magnetisme: Tiltrengningskraften mellom en magnet og et magnetisk objekt.
- Løselighet: Måling av hvor godt et stoff kan oppløse i et annet stoff.
- Smeltepunkt: temperatur hvor et stoff skifter fra fast til flytende.
- Kokepunkt: temperatur hvor et stoff skifter fra væske til gass.
- Elektrisk ledningsevne: er et mål for hvor godt strømmen beveger seg gjennom et stoff.
- Termisk ledningsevne: Hastigheten der et stoff overfører varme.
- Malleability: er et stoffs evne til å bli rullet eller malt på forskjellige måter.
- Glans eller glans: er hvor lett objektet gjenspeiler lys.
Kjemiske egenskaper av stoffet
De kjemiske egenskapene beskriver stoffets evne til å forvandle seg til et nytt stoff med forskjellige egenskaper. Nedenfor er flere eksempler på kjemiske egenskaper:
- Forbrenningsvarme: Er energien utgitt når en forbindelse gjennomgår en fullstendig forbrenning med oksygen.
- Kjemisk stabilitet: refererer til om en forbindelse vil reagere med vann eller luft (kjemisk stabile stoffer reagerer ikke).
- Brennbarhet: Et stoffs evne til å brenne ved eksponering for en flamme.
- Reaktivitet: evne til å interagere med et annet stoff og danne et eller flere nye stoffer.
Fysiske tilstander av materie
Materiell er alt som tar plass, som har masse, og som kan oppfattes av våre sanser. Materiell kan klassifiseres etter fysisk tilstand: fast, flytende og gassformig.
1- Solids og deres karakteristiske egenskaper
Alle faste stoffer har masse, opptar plass, har definert volum og form, ikke gå gjennom rom og kan ikke komprimeres eller ha en stiv form. Som eksempler har vi: tre, bøker, svamper, metall, steiner, etc..
I faste stoffer er de små partiklene av materie veldig tett sammen og berører hverandre. Partiklene er så tette at de ikke beveger seg mye, det er svært lite mellomrom mellom dem.
2- Væsker og deres karakteristiske egenskaper
Alle væsker har masse, tar opp plass, men ikke har et bestemt volum bestemt form (som de tilpasser seg den beholder hvor de er), kan presses til en meget liten grad, og kan gli gjennom rommet. Som eksempler har vi: vann, parafin, olje, etc..
I væsker er de små partiklene av materie litt lenger unna hverandre, det er mer plass mellom dem (sammenlignet med faste stoffer) og de berører ikke hverandre. Derfor kan partikler bevege seg mellom mellomrom, skyve og kollidere med andre partikler, som stadig skifter retning.
3- Gassene og deres karakteristiske egenskaper
Alle gasser har masse, opptar plass, har ikke definert volum eller form, kan komprimeres i stor grad og kan diffundere til rom. Som eksempler har vi: hydrogen, oksygen, nitrogen, karbondioksid, damp, etc..
I gasser er de små partiklene mye lenger fra hverandre, det er mye mer plass mellom dem (sammenlignet med væsker) og de berører ikke hverandre. Partiklene har maksimal bevegelsesfrihet, slik at de presser og kolliderer med andre partikler som stadig skifter retning.
Endringer i tilstanden til saken
Mater kan omdannes fra en fast tilstand til en flytende tilstand og vice versa, og fra en flytende tilstand til en gassformig tilstand og omvendt. Denne konverteringen tar navnet på tilstandsendring og skjer ved endringer i temperaturen:
fusjon
Endring av tilstanden til materialet fra fast til flytende ved hjelp av temperaturøkningen. Når et fast stoff oppvarmes, får varmen partiklene til å vibrere mer kraftig.
Ved å nå smeltepunktet for de faste partikler har tilstrekkelig kinetisk energi til å overvinne de sterke tiltrekningskrefter som holder dem i faste posisjoner, og brytes opp i små grupper av flytende partikler.
Koking eller fordampning
Forandring av tilstanden til væsken til gassformig ved hjelp av temperaturøkningen. Når et flytende stoff oppvarmes, får varmen partiklene til å bevege seg enda raskere.
Ved å nå kokepunktet til de flytende partikler har tilstrekkelig kinetisk energi til å overvinne tiltrekningskreftene som holder dem i faste posisjoner, og separeres i individuelle gasspartikler.
Frysing eller størkning
Forandring av tilstanden til væsken til fast ved hjelp av temperaturreduksjonen. Når et flytende stoff avkjøles, mister partiklene mye kinetisk energi. Når frysepunktet nås, slutter partiklene å bevege seg og vibrere i fast posisjon og blir faste partikler.
Fortvikling eller kondensering
Forandring av tilstanden til det gassformige stoffet til væske ved hjelp av temperaturnedgangen. Når en gassformig substans avkjøles, mister partiklene mye kinetisk energi som får dem til å tiltrekke seg hverandre som væskeformige partikler.
sublime
Noen materialer endres direkte fra en fast tilstand til en gassholdig tilstand, eller vice versa, uten å passere gjennom den flytende tilstand. Når disse faste stoffer oppvarmes, idet partiklene beveger seg så hurtig som er fullstendig atskilt, og danner damp eller gass, og vice versa når prosessen finner sted gassformig stoff til fast.
referanser
- De Podesta, M. Forstå materiens egenskaper, 2. utgave. Storbritannia: Taylor & Francis.
- Goel A. Materiell. New Delhi: Discovery Publishing House.
- Moore J, Stanitski C. Molekylærvitenskapen, 5. utgave. Stamford: Cengage Learning.
- Ramakrishna A. Materiellets natur, 1. utgave. New Delhi: Goyal Brothers Prakashan.
- Reger D, Goode S, Ball D. Kjemi. Prinsipper og praksis, 3. utgave. Canada: Brooks / Cole, Cengage Learning.
- Shapere D. Matter (fysikk). Hentet fra: accessscience.com.
- Singh L, Kaur M. Matter i våre omgivelser. India: S. Chand School.


