Natriumbromid (NaBr) Kjemisk struktur, egenskaper og bruksområder
den natriumbromid er en kjemisk art som tilhører saltene av uorganisk opprinnelse. Strukturen er sammensatt av brom halogenet og natriummetallelementet i forholdet 1: 1. Dens kjemiske formel er NaBr og er i en solid aggregering under standard temperatur og trykkforhold (25 ° C og 1 atm).
Normalt kan det observeres som et hvitt pulver, og det regnes som en krystallinsk type forbindelse som også manifesterer en hygroskopisk oppførsel; det vil si, det har evnen til å absorbere fuktighet fra omgivelsene.

På lignende måte har natriumbromid fysiske egenskaper som er meget lik en annen ionisk forbindelse av samme metall: natriumklorid. Dette kloridet er representert som NaCl, som er mer kjent som vanlig salt eller bordsalt.
Den har et stort antall bruksområder i ulike fagområder; for eksempel er det brukt i produksjon av de forskjellige typer medikamenter (sedativer, hypnotika, antikonvulsive midler, blant andre), som i organisk syntese, og til og med fotoapplikasjoner.
index
- 1 Kjemisk struktur
- 1.1 Kjemisk syntese
- 2 Egenskaper
- 3 bruksområder
- 4 referanser
Kjemisk struktur
Som tidligere nevnt oppstår natriumbromid i den faste fase og, som mange andre salter av uorganisk natur, har en krystallinsk strukturkonformasjon.
Dette krystallinske molekyl som består av et brom-atom og ett hydrogenatom, har en konformasjon kubisk flatesentrert type, for eksempel salter av samme metall haloid (Nal, NaCl og NaF).
Dette molekylære arrangementet danner det strukturelle grunnlaget for mange forbindelser, hvor ordningen utføres slik at hver ion holdes i midten av en oktaedisk figur, som vist i det følgende bilde.
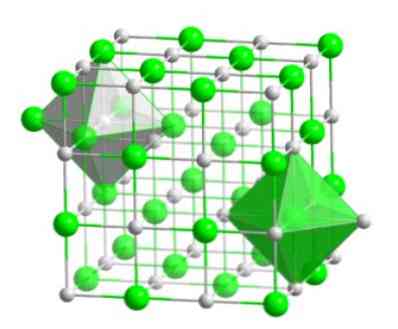
I denne typen krystall kan du se hvordan hver av ionerne har rundt det seks andre ioner - som har en motsatt elektrisk ladning - som ligger i enden av den oktaediske figuren.
Dessuten er konstruksjonen av den ioniske substans innebærer som har et høyt smeltepunkt på omtrent 747 ° C, kommersielt være i to former: en vannfri arter (ingen molekyler vann) og et dihydrat arter (med to vannmolekyler i sin Strukturell formel (NaBr · 2H2O)), hvis smeltepunkter er forskjellige.
Kjemisk syntese
Natriumbromid stammer ved kjemisk reaksjon som oppstår mellom hydrogenbromid (HBr, et hydrogenhalogenid gassfase) og natriumhydroksid (NaOH, en sterk base i fast fase og hygroskopiske egenskaper).
På denne måten fremstilles det kommersielt ved å tilsette et overskudd av brom til en oppløsning av NaOH. Dette danner en bromid / bromblanding. Deretter blir de resulterende produkter underkastet fordampning inntil tørket og behandlet med karbon for å generere reduksjonsreaksjonen av bromationen (BrO3-) til bromidionet (Br-).
opphevende
På samme måte kan dette uorganiske salt også bli fremstilt gjennom en nøytraliseringsreaksjon av natriumkarbonat (Na2CO3) med bromsyre (HBrO)3), etter samme fremgangsmåte som beskrevet ovenfor.
Gjennom en syntese kan dette stoffet produseres ved hjelp av reaksjonen mellom jern og brom og vann. Som et produkt av denne reaksjon stammer ferro-ferribromidarten opp.
Deretter dannet denne arten (representert som FeBr2/ FeBr3) oppløses i vann og en viss mengde natriumkarbonat tilsettes. Til slutt filtreres løsningen og føres gjennom en fordampingsprosess for endelig å oppnå natriumbromidet.
egenskaper
- Det finnes vanligvis i en tilstand av solid aggregering, i form av hvitt pulver.
- Den har en krystallinsk struktur, med et terningformet molekylært arrangement sentrert på ansiktene.
- Smeltepunktet for dette stoffet er ca. 747 ° C for dets vannfrie form og 36 ° C for dets dihydrerte form, som viser dekomponering før det smelter.
- Den består av en natriumion (Na+) og en bromidion (Br-), med en molar masse eller molekylvekt på 102,89 g / mol.
- Kokpunktet er ganske høyt, observert ved 1390 ° C (tilsvarende 2530 ° F eller 1660 K).
- Løseligheten av denne arten er rundt 94,32 g / 100 ml i vann ved 25 ° C, økende med økende temperatur.
- Når det utsettes for oppvarming til det punkt der det nedbrytes, frigjør dette stoffet brom- og natriumoksidgasser som er giftige.
- Tettheten av vannfri form av natriumbromid er 3,21 g / cm3, mens det for dihydratforbindelsen er 2,18 g / cm3.
- Løseligheten i alkohol anses moderat, som i andre løsningsmidler som pyridin, ammoniakk og hydrazin.
- Den har uoppløselighet mot acetonitril og aceton.
søknader
- På det medisinske området anvendes som et legemiddel for en rekke forhold som forårsaker kramper og som en terapi for forhindring av epilepsi bokser i pasienter med Wolf-Hirschhorn syndrom, så vel som sedativer og hypnotika behandlinger.
- I veterinærmedisin brukes det hos hunder som har beslagssykdommer på grunn av bivirkninger av legemidler som fenobarbital eller primidon.
- På oljeindustrien er det brukt i fremstillingsprosessene av visse væsker av varierende tetthet som brukes i oljebrønner.
- I biologisk forskning har dets mikrobiocidegenskaper blitt bevist; det vil si, det brukes til å kontrollere utviklingen av forskjellige typer bakterier.
- I visse synteser av organisk type brukes dette salt av uorganisk natur til fremstilling av andre arter som utgjøres av brom. For eksempel, ved hjelp av reaksjonen av Finkelstein, oppnås noen alkylhalogenider med større reaktivitet, hvorav den ene pleide å være ganske brukt i fotografering.
- I forbindelse med rengjøring og desinfeksjon brukes natriumbromid i kombinasjon med klor for rensing av store mengder vann, som i svømmebassenger og boblebad..
referanser
- Wikipedia. (N.d.). Natriumbromid. Hentet fra en.wikipedia.org
- Pubchem. (N.d.). Natriumbromid. Hentet fra pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Invitasjon til organisk kjemi. Hentet fra books.google.co.ve
- Science Direct. (N.d.). Natriumbromid. Hentet fra sciencedirect.com
- Riviere, J. E. og Papich, M. G. (2009). Veterinær farmakologi og terapeutikk. Hentet fra books.google.co.ve


