Butino struktur, egenskaper og anvendelser
den butyne er en kjemisk forbindelse som tilhører gruppen alkyner, karakterisert hovedsakelig ved å ha i sin struktur minst en trippelbinding mellom to karbonatomer.
Når det gjelder å etablere regler for navngiving alkyner, IUPAC (står for International Union of Pure and Applied Chemistry) har slått fast at de blir brukt som for alkener.

Den grunnleggende forskjellen mellom nomenklaturen for begge typer stoffer er at suffikset -one er forandret til-eller når det gjelder forbindelser som har tredobler i sin struktur.
På den annen side, butyn består utelukkende av karbon og hydrogen, og kommer i to former: 1-butyn, som er i gassfase under betingelser med standard temperatur og trykk (1 atm, 25 ° C); og 2-butino, som er en flytende faseart produsert ved kjemisk syntese.
index
- 1 Kjemisk struktur
- 1,1 1-butino
- 1,2 2-butyn
- 2 Egenskaper
- 3 bruksområder
- 4 referanser
Kjemisk struktur
I molekylet kjent som butino presenteres fenomenet strukturell isomerisering av posisjon, som består i nærvær av de samme funksjonelle grupper i begge forbindelser, men hver av disse er i et annet sted av kjeden.
I dette tilfelle har begge former av butino en identisk molekylformel; I 1-butyn er den trippelbinding imidlertid plassert i karbon nummer én, mens i 2-butyn finnes den i nummer to. Dette omdanner dem til isomerer.
På grunn av plasseringen av trippelbindingen i en av terminalene av strukturen av 1-butyn, anses det som et terminal alkyn, mens midtstilling av trippelbindingen i strukturen av 2-butyn gir klassifisering indre alkyn.
Koblingen kan således bare være mellom det første og andre karbon (1-butyn) eller mellom det andre og tredje karbon (2-butyn). Dette skyldes den anvendte nomenklaturen, hvor den laveste mulige nummereringen alltid vil bli gitt til den tredobbelte obligasjonsposisjonen.
1-butyn
Forbindelsen kalt 1-butyn er også kjent som etylacetylen, på grunn av dens struktur og måten de fire karbonatomer er anordnet på og bundet til. Men når du snakker om butyne Det refereres kun til denne kjemiske arten.
I dette molekylet er den trippelbindingen funnet i en terminal karbon, som tillater tilgjengeligheten av hydrogenatomer som gir den stor reaktivitet.
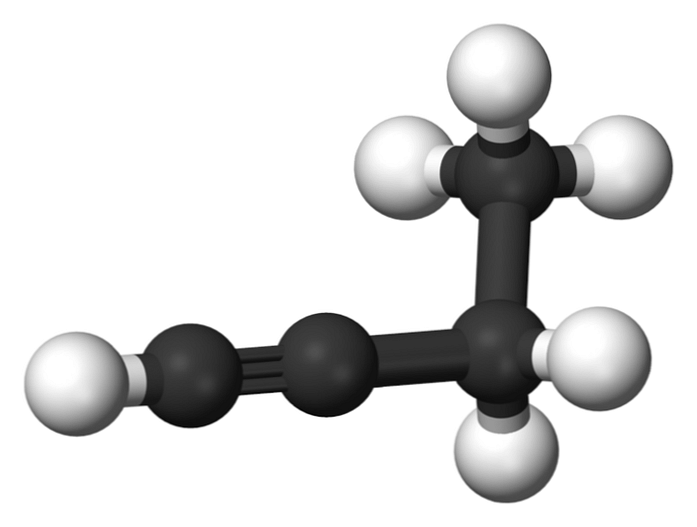
Denne stive og sterkere bindingen enn en enkelt- eller dobbeltbinding mellom karbonatomene gir en stabil konfigurasjon av 1-butynlinjær geometri.
På den annen side er dette gassformige stoffet ganske brennbart, så i nærvær av varme kan det lett forårsake branner eller eksplosjoner og har stor reaktivitet i nærvær av luft eller vann.
2-butyn
Siden interne alkyner utviser større stabilitet enn terminale alkyner, tillater de omdannelse av 1-butyn til 2-butyn.
Denne isomerisering kan skje ved oppvarming av 1-butyn i nærvær av en base (for eksempel NaOH, KOH, NaOCH3 ...) eller ved ombytting av 1-butyn i en løsning av kaliumhydroksid (KOH) i etanol (C-2H6O).
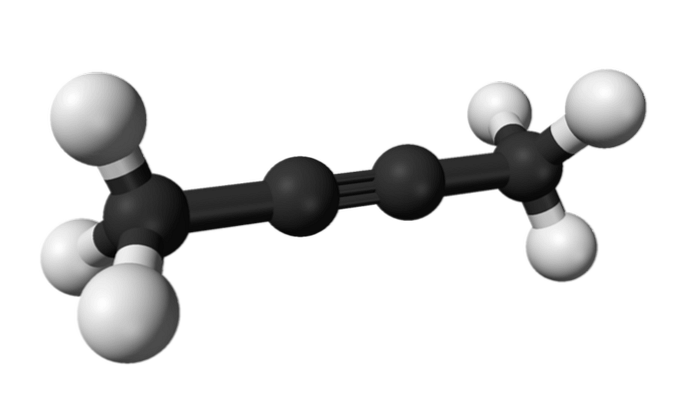
På samme måte kalles kjemikaliet kjent som 2-butyn også dimetylacetylen (eller krotonylen), som presenterer seg som en flytende og flyktig art som opprinnelig kommer fra.
I 2-butyn er trippelbindingen midt i molekylet, noe som gir den større stabilitet enn isomeren.
I tillegg har denne fargeløse forbindelsen en lavere tetthet enn vann, selv om den anses å være uoppløselig i den og har høy brennbarhet.
egenskaper
-Den strukturelle formel for butino (uavhengig av hvilken isomer refereres) er C4H6, som har en lineær struktur.
-En av de kjemiske reaksjonene som er rammet av butinmolekylet, er isomerisering, der en omplassering og migrasjon av trippelbindingen skjer i molekylet.
-1-Butyne er i gassfase, har en meget høy brennbarhet og høyere tetthet enn luft.
-Dette stoffet er også ganske reaktivt, og i nærvær av varme kan det forårsake voldsomme eksplosjoner.
-I tillegg, når denne fargeløse gass opplever en ufullstendig forbrenningsreaksjon, kan det forårsake karbonmonoksid (CO)
-Når begge isomerene blir utsatt for høye temperaturer, kan de oppleve eksplosiv-type polymerisasjonsreaksjoner.
-2-butyn er i væskefasen, selv om det også anses å være ganske brennbart under standardtrykk og temperaturforhold.
-Disse stoffene kan oppleve voldelige reaksjoner når de er i nærheten av sterke oksiderende stoffer.
-På samme måte oppstår eksoterme reaksjoner med en konsekvent frigjøring av gassformig hydrogen når i nærvær av reduserende arter..
-Når det er funnet i kontakt med visse katalysatorer (som visse sure stoffer) eller forgreningsarter, kan eksoterme polymerisasjonsreaksjoner oppstå.
søknader
Fordi de har noen forskjellige egenskaper, kan begge isomerer ha forskjellige bruksområder og applikasjoner, som vist nedenfor:
For det første er en av anvendelsene av 1-butino ofte bruk som et mellomstadium i produksjonsprosessen av andre stoffer av organisk natur av syntetisk opprinnelse..
På den annen side brukes denne kjemiske arten i fremstillingsindustrien av gummi og avledede forbindelser; som for eksempel når du vil få bensol.
Tilsvarende benyttes den i fremstillingsprosessen av et bredt spekter av plastprodukter, så vel som ved fremstilling av mange polyetylenstoffer som anses høy tetthet.
Også, 1-butyn brukes ofte som en komponent for skjære- og sveiseprosesser av noen metalllegeringer, inkludert stål (jernlegering og karbon)..
På en annen måte er den isomer 2-butyne anvendes i kombinasjon med en annen navngitt alkyn propyn i syntesen av enkelte stoffer som er kjent som alkylerte hydrokinoner, når prosessen for syntese av α-Total tokoferol (vitamin E) er utført.
referanser
- Wikipedia. (N.d.). Butyne. Hentet fra en.wikipedia.org
- Yoder, C.H., Leber P.A. og Thomsen, M.W. (2010). Broen til organisk kjemi: Konsepter og nomenklatur. Hentet fra books.google.co.ve
- Study.com. (N.d.). Butyne: Strukturell formel og isomerer. Oppnådd fra studie.
- Pubchem. (N.d.). 1-butyn. Hentet fra pubchem.ncbi.nlm.nih.gov
- Pubchem. (N.d.). 2-butyn. Hentet fra pubchem.ncbi.nlm.nih.gov


