Sykloheksanstruktur, egenskaper, syntese og bruk
den sykloheksen er en alken eller cyklisk olefin hvis molekylformel er C6H10. Den består av en fargeløs væske, uoppløselig i vann og blandbar med mange organiske løsningsmidler. Det er preget av å være brannfarlig, og i naturen finnes det vanligvis i kullærer..
Sykloheksen syntetiseres ved delvis hydrogenering av benzen og ved dehydrering av alkoholcykloheksanol; det er en mer rusten form. Som andre cycloalkener gjennomgår det reaksjoner av elektrofil tillegg og med frie radikaler; for eksempel halogeneringsreaksjonen.
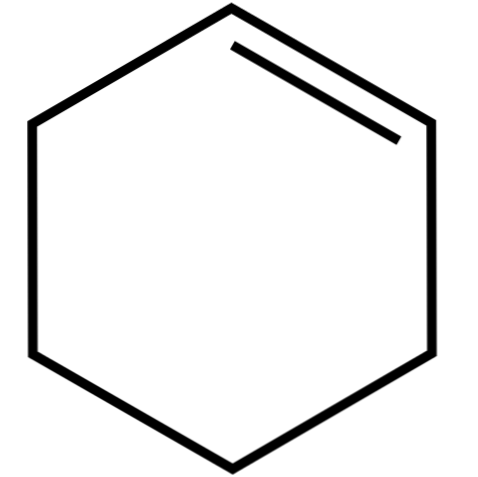
Denne cykliske alkenen (toppbildet) danner azeotropiske blandinger (ikke separerbare ved destillasjon), med lavere alkoholer og eddiksyre. Det er ikke veldig stabilt i langvarig lagring, siden det brytes ned under påvirkning av sollys og ultrafiolett stråling.
Sykloheksen brukes som løsningsmiddel, og har derfor mange anvendelser, for eksempel: stabilisator av høyoktan-gassoliner og for utvinning av oljer.
Men mest viktig, er det at den cykloheksen er mellomleddet og råstoff for fremstilling av tallrike forbindelser som er egnet, inkludert: cykloheksanon, adipinsyre, maleinsyre, cykloheksan, butadien, cykloheksylkarboksylsyre, etc..
index
- 1 Struktur av cykloheksen
- 1.1 Intermolekylære interaksjoner
- 2 Egenskaper
- 2.1 Kjemiske navn
- 2,2 Molekylvekt
- 2.3 Fysisk utseende
- 2.4 lukt
- 2,5 kokepunkt
- 2.6 Smeltepunkt
- 2.7 Flammepunkt
- 2,8 Løselighet i vann
- 2.9 Løselighet i organiske løsningsmidler
- 2,10 tetthet
- 2.11 Damptetthet
- 2.12 Damptrykk
- 2.13 Selvantennelse
- 2.14 Nedbrytning
- 2,15 Viskositet
- 2.16 Forbrenningsvarme
- 2.17 Fordampingsvarme
- 2.18 Overflatespenning
- 2.19 Polymerisering
- 2.20 Luktgrense
- 2.21 Brekningsindeks
- 2,22 pH
- 2.23 Stabilitet
- 2.24 Reaksjoner
- 3 Sammendrag
- 4 bruksområder
- 5 risikoer
- 6 Referanser
Struktur av cykloheksen
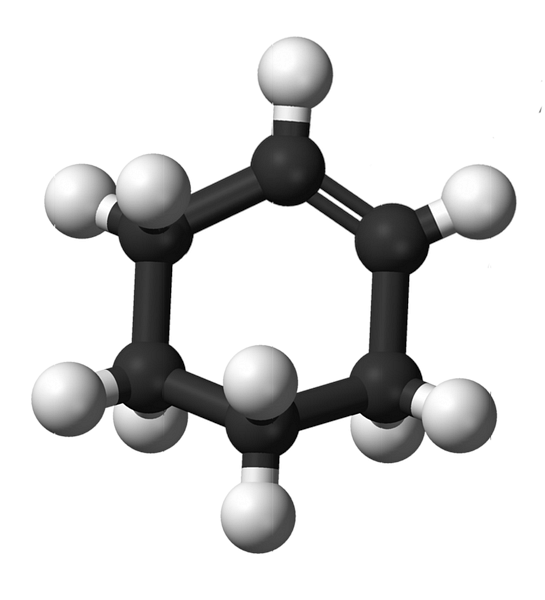
Strukturen av cykloheksen med en modell av kuler og barer er vist i bildet ovenfor. Man kan legge merke til de seks karbonringen og dobbeltbindingen, begge umettighetene til forbindelsen. Fra dette perspektivet ser det ut til at ringen er flat; men det er ikke i det hele tatt.
For det første har karbonene i dobbeltbindingen sp hybridisering2, som gir dem en trigonalplan geometri. Derfor er disse to karbonene, og de som ligger ved siden av dem, i samme plan; mens de to karbonene i motsatt ende (til dobbeltbindingen) er over og under nevnte planet.
Det nedre bildet illustrerer perfekt det som nettopp har blitt forklart.

Legg merke til at svartbåndet består av fire karboner: de to av dobbeltbindingen, og de andre som støter til dem. Det synlige perspektivet er det som ville bli oppnådd dersom en tilskuer plasserte øyet rett foran dobbeltbonden. Det kan da sees at et karbon er over og under dette flyet.
Siden cykloheksenmolekylet ikke er statisk, vil de to karbonene bytte ut: man vil senke mens den andre vil stige over flyet. Så du forventer at molekylet skal oppføre seg.
Intermolekylære interaksjoner
Sykloheksen er et hydrokarbon, og derfor er dets intermolekylære interaksjoner basert på dispersjonskreftene i London.
Dette er fordi molekylet er apolare, uten permanent dipolmoment, og dets molekylvekt er den mest medvirkende faktor i å holde den flytende kohesivt.
Dessuten øker den dobbeltbindingen graden av interaksjon som den ikke kan bevege seg med den samme fleksibilitet som de andre karbon, og dette fremmer samspillet mellom nabomolekyler. Det er av denne grunn at cykloheksen har et litt høyere kokepunkt (83 ° C) enn cykloheksan (81 ° C).
egenskaper
Kjemiske navn
Sykloheksen, tetrahydrobenzen.
Molekylvekt
82,146 g / mol.
Fysisk utseende
Fargeløs væske.
lukt
Søt lukt.
Kokepunkt
83 ºC til 760 mmHg.
Smeltepunkt
-103,5 ºC.
Tennspunkt
-7ºC (lukket kopp).
Løselighet i vann
Nesten uoppløselig (213 mg / l).
Løselighet i organiske løsningsmidler
Blandbar med etanol, benzen, karbontetraklorid, petroleumseter og aceton. Det forventes at det vil være i stand til å oppløse apolære forbindelser, som noen av allotropene av kull.
tetthet
0,810 g / cm3 ved 20ºC.
Damptetthet
2,8 (i forhold til luften tatt lik 1).
Damptrykk
89 mmHg ved 25ºC.
Selvantennelse
244 ºC.
nedbrytning
Dekomponerer i nærvær av uransalter, under påvirkning av sollys og ultrafiolett stråling.
viskositet
0,625 mPascal ved 25 ºC.
Forbrenningsvarme
3,751,7 kJ / mol ved 25ºC.
Fordampingsvarme
30,46 kJ / mol ved 25 ºC.
Overflatespenning
26,26 mN / m.
polymerisasjon
Det kan polymerisere under visse forhold.
Luktgrense
0,6 mg / m3.
Brytningsindeks
1,4465 ved 20 ºC.
pH-
7-8 ved 20ºC.
stabilitet
Sykloheksen er ikke veldig stabil under langvarig lagring. Eksponering for lys og luft kan forårsake produksjon av peroksider. På samme måte er det uforenlig med sterke oksidasjonsmidler.
reaksjoner
-Sykloalkener opplever hovedsakelig tilleggsreaksjoner, både elektrofile og frie radikaler.
-Reagerer med brom for å danne 1,2-dibromcykloheksan.
-Oksiderer raskt i nærvær av kaliumpermanganat (KMnO4).
-Det er i stand til å produsere et epoksid (cykloheksenoksyd) i nærvær av peroksybenzosyre.
syntese
Sykloheksen fremstilles ved syrekatalyse av cykloheksanol:
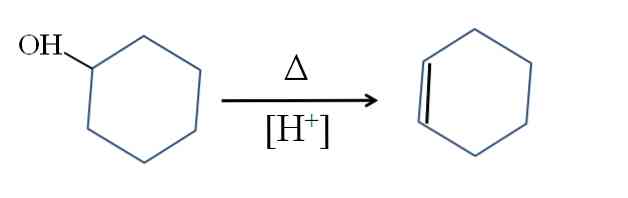
Symbolet A representerer varmen som er nødvendig for å fremme utgangen av OH-gruppen som et vannmolekyl i surt medium (-OH2+).
Sykloheksen produseres også ved delvis hydrogenering av benzen; det vil si at to av sine dobbeltbindinger legger til et hydrogenmolekyl:
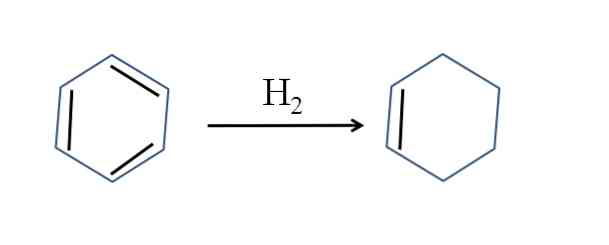
Selv om reaksjonen virker enkel, krever det store trykk på H2 og katalysatorer.
søknader
-Det har nytte som et organisk løsningsmiddel. Det er også et råmateriale for fremstilling av adipinsyre, adipinsyre aldehyd, maleinsyre, cykloheksan og cykloheksylkarboksylsyre.
-Det brukes til produksjon av cykloheksanklorid, en forbindelse som brukes som mellomprodukt i fremstilling av farmasøytiske produkter og gummitilsetninger..
-Sykloheksen brukes også i syntese av cykloheksan, råmateriale til produksjon av medisiner, plantevernmidler, parfymer og fargestoffer.
-Sykloheksen er involvert i syntesen av aminocykloheksanol, en forbindelse som brukes som et overflateaktivt middel og emulgeringsmiddel..
-I tillegg kan cykloheksen brukes til fremstilling i laboratoriet av butadien. Den sistnevnte forbindelsen brukes til fremstilling av syntetisk gummi, til fremstilling av dekk til biler, og brukes også til fremstilling av akrylplast.
-Sykloheksen er råmaterialet til syntese av lysin, fenol, polycykloolefinharpiks og gummi tilsetningsstoffer.
-Den brukes som en stabilisator av høyoktan-bensoliner.
-Involvert i syntesen av vanntette belegg, sprekkfaste filmer og bindende bindemidler for belegg.
risikoer
Sykloheksen er ikke en veldig giftig forbindelse, men det kan forårsake rødhet av hud og øyne ved kontakt. Dens innånding kan gi hoste og døsighet. I tillegg kan inntaket føre til døsighet, pustevansker og kvalme.
Sykloheksen absorberes dårlig i mage-tarmkanalen, slik at ingen alvorlige systemiske effekter forventes på grunn av inntak. Den største komplikasjonen er aspirasjonen ved åndedrettssystemet, som kan produsere kjemisk lungebetennelse.
referanser
- Joseph F. Chiang, og Simon Harvey Bauer. (1968). Molekylær struktur av cykloheksen. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Sykloheksen: Fare, syntese og struktur. Study. Hentet fra: study.com
- Morrison, R. T. og Boyd, R. N. (1987). Organisk kjemi (5tA Edition.). Redaktør Addison-Wesley Iberoamericana.
- Pubchem. (2019). Sykloheksen. Hentet fra: pubchem.ncbi.nlm.nih.gov
- Kjemisk bok. (2019). Sykloheksen. Hentet fra: chemicalbook.com
- Toksikologiske datanettverk. (2017). Sykloheksen. Toxnet. Hentet fra: toxnet.nlm.nih.gov
- Chemoxy. (N.d.). Strukturformelen for cykloheksen er. Hentet fra: chemoxy.com


