Egenskaper for natriumdikromat, produksjon, farer og bruksområder
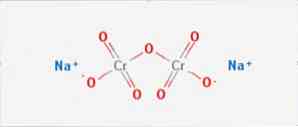
den natriumdikromat er en uorganisk forbindelse med formel Na2Cr207. Det er en av mange heksavalente kromforbindelser (Cr VI). Dens struktur er illustrert i figur 1, men vanligvis blir saltet håndtert i sin dihydrerte form hvis formel vil være Na2Cr207 · H2O.
Den har to ioniske bindinger mellom natriummolekylene og de negativt ladede oksygene. Krommalmen ekstraheres fra natriumdikromat. Millioner kilo natriumdikromat blir produsert årlig.
Kina er den største produsenten av natrium dichromate, men kinesiske kjemiske anlegg har en relativt lav produksjon, mindre enn 50.000 tonn per år hver, mot Kasakhstan anlegg som produserer mer enn 100.000 tonn per år.
Planter i Russland, USA og Storbritannia har en mellomproduksjon mellom 50.000 og 100.000 tonn per år (Kogel, 2006).
Når det gjelder reaktivitet og utseende, har natriumdikromat egenskaper lik kaliumdikromat, men natriumsaltet er mer løselig i vann og har en vektekvivalent mindre enn kaliumsaltet.
Natriumdikromat gir giftige kromdamp ved oppvarming. Det er et sterkt oksidasjonsmiddel og er sterkt etsende.
Denne forbindelsen kan bli funnet i drikkevannskilder forurenset av forskjellige industrielle prosesser som for eksempel galvanisering eller galvaniseringsteknikker, skinnarbeid og tekstilproduksjon.
index
- 1 Fysiske og kjemiske egenskaper
- 2 Produksjonsmetoder
- 3 Reaktivitet og farer
- 4 bruksområder og applikasjoner
- 5 biokjemi
- 6 Referanser
Fysiske og kjemiske egenskaper
Natriumdikromat består av krystaller med en rødaktig oransje monoklinisk struktur i deres vannfrie og luktfrie form. Dens molekylvekt er 261,97 g / mol i vannfri form og 298,00 g / mol i dens dihydrerte form.
Den har et smeltepunkt på 356,7 grader Celsius, et kokepunkt på 400 grader Celsius hvor det nedbrytes. Den har en tetthet på 2,52 g / ml.

Figur 2 viser utseendet av natriumdikromat. Dets oppløselighet i vann er 187 g per 100 g ved 25 grader Celsius, og dets løselighet i etanol er 513,2 gram per liter til 19,4 grader Celsius (National Center for Biotechnology Information, S. F.).
Det regnes som en stabil forbindelse hvis den oppbevares under de anbefalte forholdene og ikke er brannfarlig. Siden det er et sterkt oksidasjonsmiddel, er det etsende, og i oppløsning er det syre som har muligheten til å senke pH til 4 i en oppløsning på 1% vekt / volum.
Produksjonsmetoder
Natriumkromat kan omdannes til dikromat ved en kontinuerlig prosess som behandler med svovelsyre, karbondioksid eller en kombinasjon av disse to.
Fordampning av natriumdikromat væske forårsaker utfelling av natriumsulfat og / eller natrium-bikarbonat, og disse forbindelser er fjernet før den endelige krystalliseringen av natriumbikromat.
Natriumdikromat kan gjøres i en tre-trinns prosess:
- Alkalisk steking av kromittoksydasjonsbetingelser
- Utlekking. Ekstraksjon av løselig substans fra en blanding ved virkningen av et flytende løsningsmiddel
- Omdannelse av natriummonokromat i natriumdikromat ved hjelp av en syre.
Vannfritt natriumdikromat kan fremstilles ved å smelte natriumdikromat-dihydrat, krystallisering av vandige oppløsninger av dikromat over 86 grader C, eller tørking av oppløsninger av natriumdikromat i spraytørkere.
Natriumdikromat løsninger ved 69 og 70% vekt / volum er brukt som en praktisk og kostnadseffektiv metode for å sende mengder, som unngår behovet for manuell håndtering eller oppløsning av krystaller.
Reaktivitet og farer
Det er et sterkt oksidasjonsmiddel. Uforenlig med sterke syrer. Kontakt med brennbare materialer kan forårsake brann. Giftige damper av kromoksid kan dannes i nærvær av varme eller brann.
Den kjente "kromsyreblandingen" av dikromat og svovelsyre med organiske rester gir opphav til en voldsom eksoterm reaksjon. Denne blandingen i kombinasjon med acetonrester fører også til en voldsom reaksjon.
Kombinasjonen av dikromat og svovelsyre med alkoholer, etanol og 2-propanol gir opphav til en voldsom eksoterm reaksjon. På grunn av forekomsten av mange hendelser som involverer blanding av dikromat-svovelsyre med oksiderbare organiske materialer, er det sannsynligvis best å unngå slike interaksjoner.
Kombinasjonen av dikromat med hydrazin er eksplosiv, dikromatreaksjonen kan forventes å være kraftig med aminer generelt. Tilsetningen av det dehydrerte dikromat salt til eddiksyreanhydrid fører til en eksplosiv eksoterm reaksjon.
Bore, silisium og dikromater danner pyrotekniske blandinger. En blanding av eddiksyre, 2-metyl-2-pentenal og dikromat fører til en rampant reaksjon (Chemical Data Sheet Sodium Dichromate., 2016).
Innånding av støv eller tåke forårsaker irritasjon i luftveiene som noen ganger ligner astma. Septal perforering kan forekomme. Det regnes som gift.
Svelging forårsaker oppkast, diaré og, svært uvanlig, komplikasjoner i mage og nyre. Kontakt med øyne eller hud forårsaker lokal irritasjon. Gjentatt eksponering for huden forårsaker dermatitt.
Natriumdikromat er et karsinogen hos mennesker. Det er tegn på at heksavalente kromforbindelser eller Cr (VI) kan forårsake lungekreft hos mennesker. Det har blitt vist at natriumdikromat forårsaker lungekreft hos dyr.
Mens natriumdikromat ikke er blitt identifisert som en teratogen forbindelse eller reproduksjons risiko, er det kjent at forbindelser av seksverdig krom Cr (VI) er teratogens og forårsake skader på forplantningsevnen og redusere fertiliteten og interferere med menstruasjonssykluser.
Natriumdikromat kan forårsake skader på lever og nyre, slik at det må håndteres med stor forsiktighet (New Jersey Department of Health, 2009).
Ved inntak skal offeret drikke vann eller melk; Ikke fremkall brekninger. Ved kontakt med hud eller øyne skal det behandles som syreforbrenninger; Skyll øynene med vann i minst 15 minutter.
Eksterne skader kan gnides med en 2% løsning av natriumtiosulfat. I alle tilfeller bør en lege konsulteres.
Bruk og applikasjoner
Bortsett fra dets betydning ved fremstilling av andre kromkjemikalier har natriumdikromat også mange direkte anvendelser som en ingrediens i produksjonen av:
- Metallisk finish: hjelper korrosjonsmotstanden og rengjør metalloverflatene, og favoriserer også malingens klebemiddel.
- Økologiske produkter: brukes som oksidasjonsmidler ved fremstilling av produkter som vitamin K og voks.
- Pigmenter: brukes til fremstilling av uorganiske kromatpigmenter der det produserer en rekke farger som er stabile for lys. Noen karakterer av kromat er også brukt som inhibitorer av korrosjon i de nedre lagene og primere.
- Keramisk: brukes til fremstilling av farget glass og keramiske glasurer.
- Tekstil: brukes som en mordant for sure fargestoffer for å forbedre sine fargestoffer.
- Produksjon av kromsulfat.
(Natriumdikromat, Byggesteinen for praktisk talt alle andre kromforbindelser., 2010-2012)
Natriumdikromat Dihydrat, dets bruk er ideell i forskjellige forhold, inkludert høytemperaturapplikasjoner, for eksempel keramiske glasurer og farget glass.
Kromoksyd, som er vanskeligere enn andre metalloksyder, som titan eller jern, er ideelt for miljøer der temperatur og prosessforhold er aggressive.
Dette stoffet brukes hovedsakelig til å produsere andre kromforbindelser, men det brukes også i bentonittmudder som brukes til produksjon av olje, i trebeskyttelsesmidler, i produksjon av organiske kjemikalier og som korrosjonshemmer..
Når det blandes med aluminium- og kaliumdikromat, ved hjelp av den alumino-termiske prosessen, produserer det kromoksyd metallisk krom av høy renhet. Dette er en viktig ingrediens i produksjonen av high performance superlegeringer som brukes i luftfartsindustrien.
Ved organisk syntese anvendes natriumdikromat som et oksidasjonsmiddel i reduksjonsoksydreaksjoner i nærvær av svovelsyre.
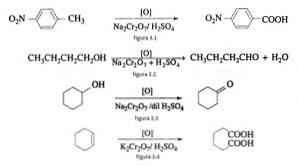
For eksempel ved oksydasjon av p-nitrotoluen for å danne p-nitrobenzosyre ved oksydasjon av n-butanol for å danne n-butaldehido, i dannelsen av cykloheksanon fra cykloheksanol og dannelsen av adipinsyre som illustrert i figurene 3.1 , 3,2, 3,3 og 3,4 (VK Ahluwalia, 2004).
biokjemi
Intratrakeal instillasjon av natriumdikromat (CrVI) og kromacetat hydroksid (CrIII) i hannrotter resulterte i økt konsentrasjon av krom er i helt blod, plasma og urin opptil 72 timer etter eksponering; Maksimal konsentrasjon ble nådd 6 timer etter eksponering.
Forholdet mellom helkromkrom og plasmakromkonsentrasjoner var signifikant forskjellig for Cr (VI) og Cr (III) behandlinger. Derfor bør analyser av krom i blod og krom i plasma brukes til evaluering av kromeksponering.
Krom ble også påvist i perifere lymfocytter. Cr (VI), men ikke Cr (III) akkumulert signifikant i lymfocytter etter behandling. Disse cellene har potensial til å bli brukt som biomarkører i evalueringen av eksponering for kromforbindelser (Hooth, 2008).
referanser
- Kjemisk datablad Natriumdikromat. (2016). Hentet fra cameo kjemikalier: cameochemicals.noaa.
- Hooth, M.J. (2008). Teknisk rapport om toksikologi og karsinogenesestudier av natriumdikromatdihydrated. National Institute of Health USA.
- Kogel, J. E. (2006). Industrielle mineraler og bergarter: Råvarer, markeder og bruksområder syvende utgave. littleton colorado: samfunn av gruvedrift, metallurgi og leting ink.
- Nasjonalt senter for bioteknologisk informasjon. (N.d.). PubChem Compound Database; CID = 25408. Hentet fra pubchem.com: pubchem.ncbi.nlm.nih.gov.
- New Jersey Department of Health. (2009, november). Hazardous Substance Faktablad natriumdikromat. Hentet fra nj.gov: nj.gov.
- Natriumdikromat. Byggeklossen for praktisk talt alle andre kromforbindelser. (2010-2012). Hentet fra elementisk krom: elementischromium.com
- K. Ahluwalia, R. A. (2004). Omfattende praktisk organisk kjemi: Preparater og kvantitative analyser. Delhi: Universitetspressen (India).


