Etanstruktur, egenskaper, bruk og risiko
den etan er et enkelt hydrokarbon med formel C2H6 med en natur fargeløs og luktfri gass som har en svært verdifull og diversifisert bruk i syntesen av etylen. I tillegg er det en av de jordbaserte gassene som også er oppdaget i andre planeter og stjernekropper rundt Solsystemet. Det ble oppdaget av forskeren Michael Faraday i år 1834.
Blant det store antall organiske forbindelser som dannes ved karbonatomer og hydrogen (kjent som hydrokarboner), det er de som er i gassform ved normale temperaturer og trykk, som blir brukt i mange industrier sterkt.
Disse kommer vanligvis fra den gassformige blanding som kalles "naturgass", et produkt av høy verdi for menneskeheten, og blander metan, blant annet metan, etan, propan og butan; klassifisert i henhold til mengden karbonatomer i sin kjede.
index
- 1 Kjemisk struktur
- 1.1 Syntese av etan
- 2 Egenskaper
- 2.1 Løselighet av etan
- 2.2 Krystallisering av etan
- 2.3 Forbrenning av etan
- 2.4 Etan i atmosfæren og i himmellegemer
- 3 bruksområder
- 3.1 Etylenproduksjon
- 3.2 Opplæring av grunnleggende kjemikalier
- 3.3 Kjølemiddel
- 4 risiko for etan
- 5 referanser
Kjemisk struktur
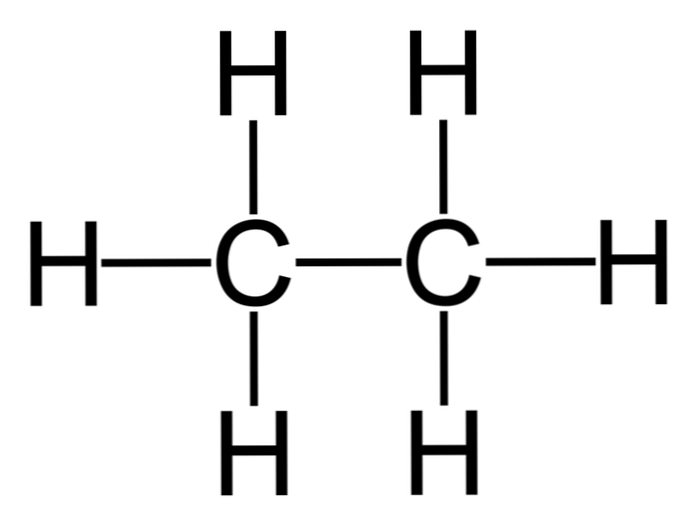
Etan er et molekyl med formel C2H6, vanligvis sett som en forening av to metylgrupper (-CH3) for å danne hydrokarbonet av en enkel karbon-karbonbinding. Det er også den enkleste organiske forbindelsen etter metan, representert som følger:
H3C-CH3
Kullatomer i dette molekylet besitter sp hybridisering3, så de molekylære bindingene presenterer fri rotasjon.
Dessuten er det en iboende fenomen av etan, som er basert på rotasjon av molekylstrukturen derav, og den minste energi som kreves for å frembringe en rotasjon av koblingen 360, som forskere har navngitt "barriere etan".
Av denne grunn kan etan forekomme i forskjellige konfigurasjoner i henhold til dens rotasjon, selv om det er mer stabil konformasjon der hydrogenene er motsatt hverandre (som vist på figuren).

Syntese av etan
Etan kan lett syntetiseres fra Kolbe elektrolyse, et organisk reaksjon hvori to trinn finner sted: en elektrokjemisk dekarboksylering (fjernelse av karboksyl-gruppen og frigivelse av karbondioksyd) av to karboksylsyrer, og kombinasjonspreparater mellomprodukter for å danne et kovalent bindemiddel.
Tilsvarende fører elektrolysen av eddiksyre til dannelsen av etan og karbondioksid, og denne reaksjonen brukes til å syntetisere den første.
Oksidasjon av eddiksyreanhydrid ved virkningen av peroksider, et konsept som ligner på Kolbe's elektrolyse, resulterer også i dannelsen av etan.
På samme måte kan den effektivt separeres fra naturgass og metan ved en flytende prosess, ved hjelp av kryogene systemer for å fange denne gassen og skille den fra blandinger med andre gasser..
Fremgangsmåten i turboekspanderen er foretrukket for denne rolle: den passerer gassblandingen gjennom en turbin, genererer en utvidelse av samme, før temperaturen synker under -100 ° C.
Allerede på dette tidspunkt kan komponentene i blandingen differensieres, slik at væskenetanen skilles fra gassformet metan og de andre artene som er involvert i bruk av en destillasjon.
egenskaper
Etan forekommer i naturen som en luktfri og fargeløs gass ved standardtrykk og temperaturer (1 atm og 25 ° C). Den har et kokepunkt på -88,5 ºC, og et smeltepunkt på -182.8 ºC. I tillegg er det ikke påvirket av eksponering for sterke syrer eller baser.
Etanoloppløselighet
Ethanamolekylene er av symmetrisk konfigurasjon og har svake tiltrekningskrefter som holder dem sammen, kalt sprengningskrefter.
Når etan blir forsøkt å oppløse seg i vann, er tiltrekningskreftene dannet mellom gassen og væsken svært svake, slik at det er svært vanskelig å bli med etan med vannmolekyler.
Av denne grunn er løseligheten av etan betydelig lav, noe som øker noe når systemtrykket stiger.
Krystallisering av etan
Etan kan størkne, noe som resulterer i dannelse av ustabile etankrystaller med en kubisk krystallinsk struktur.
Med en temperaturnedgang utover -183,2 ° C, blir denne strukturen monoklinisk, og øker stabiliteten av molekylet.
Etanforbrenning
Dette hydrokarbonet, selv om det ikke er mye brukt som drivstoff, kan brukes i forbrenningsprosesser for å generere karbondioksid, vann og varme, som er representert som følger:
2C2H6 + 7O2 → 4CO2 + 6H2O + 3120 kJ
Det er også mulig å brenne dette molekylet uten overskudd av oksygen, som er kjent som "ufullstendig forbrenning" og resulterer i dannelse av amorft karbon og karbonmonoksyd i en uønsket reaksjon som den oksygeninntrengning :
2C2H6 + 3O2 → 4C + 6H2O + Varme
2C2H6 + 4O2 → 2C + 2CO + 6H2O + Varme
2C2H6 + 5O2 → 4CO + 6H2O + Varme
I dette området skjer forbrenning gjennom en rekke friradikalreaksjoner, som er nummerert i hundrevis av forskjellige reaksjoner. For eksempel kan forbindelser som formaldehyd, acetaldehyd, metan, metanol og etanol bli dannet i ufullstendige forbrenningsreaksjoner..
Dette vil avhenge av forholdene under hvilke reaksjonen oppstår og de frie radikale reaksjoner som er involvert. Etylen kan også dannes ved høye temperaturer (600-900 ºC), som er et produkt som er svært ønsket av industrien.
Etan i atmosfæren og himmellegemer
Etan er tilstede i atmosfæren på planeten Jorden i spor, og det er mistenkt at mennesket har klart å fordoble denne konsentrasjonen siden han begynte å praktisere industrielle aktiviteter.
Forskere tror at mye av den aktuelle Nærværet av etan i atmosfæren på grunn av forbrenning av fossile brennstoffer, selv om den globale utslipp av etan er redusert med nesten halvparten siden produksjonsteknologier skifergass ble forbedret (ett naturgasskilde).
Denne arten produseres også naturlig ved effekten av solstråler på atmosfærisk metan, som rekombinerer og danner etanol av etan.
Etan finnes i flytende tilstand på overflaten av Titan, en av Saturns måner. Dette skjer i større mengder i Vid Flumina-elven, som strømmer i mer enn 400 kilometer mot en av sine hav. Det har også blitt påvist denne forbindelsen på kometer, og på overflaten av Pluto.
søknader
Etylenproduksjon
Bruken av etan er hovedsakelig basert på produksjon av etylen, det mest brukte organiske produktet i verdensproduksjonen, gjennom en prosess kjent som dampkrakking..
Denne prosessen består av å passere et mat av etan fortynnet med damp til en ovn, oppvarming det raskt uten oksygen.
Reaksjonen skjer ved ekstremt høy temperatur (mellom 850 og 900 ºC), men oppholdstiden (tiden som er brukt av etan i ovnen) må være kort for at reaksjonen skal være effektiv. Ved høyere temperaturer genereres mer etylen.
Opplæring av grunnleggende kjemikalier
Etan har også blitt studert som en hovedkomponent i dannelsen av grunnleggende kjemikalier. Oksidativ klorering er en av prosessene som foreslås for å oppnå vinylklorid (en komponent av PVC), erstatte billigere og mer kompliserte.
kjøle
Endelig brukes etan som et kjølemiddel i vanlige kryogene systemer, og viser også evnen til å fryse små prøver i laboratoriet for analyse.
Det er en veldig god erstatning for vann, noe som tar lengre tid å avkjøle de delikate prøvene, og kan også generere dannelsen av skadelige iskrystaller.
Ethan risiko
-Etan har evnen til å antennes, spesielt når den binder med luft. Ved prosenter på 3,0 til 12,5% volum etan i luften kan en eksplosiv blanding dannes.
-Det kan begrense oksygenet i luften der det er funnet, og av denne grunn er det en risikofaktor for kvelning for mennesker og dyr som er tilstede og utsatt.
-Etan i frossen væskeform kan sterkt brenne huden hvis den kommer i direkte kontakt med den, og fungerer også som et kryogen medium for ethvert objekt det berører, fryser det i øyeblikk.
-Dampene av flytende etan er tyngre enn luft og er konsentrert på bakken, dette kan utgjøre en fare for tenning som kan generere en kjedeforbrenningsreaksjon.
-Inntak av etan kan forårsake kvalme, oppkast og intern blødning. Innånding, i tillegg til kvelning, forårsaker hodepine, forvirring og humørsvingninger. Død på grunn av hjertestans er mulig ved høye eksponeringer.
-Det representerer en klimagass som sammen med metan og karbondioksid bidrar til global oppvarming og klimaendringer som følge av menneskelig forurensning. Heldigvis er det mindre rikelig og holdbart enn metan, og absorberer mindre stråling enn dette.
referanser
- Britannica, E. (s.f.). Etan. Hentet fra britannica.com
- Nes, G. V. (s.f.). Enkeltkrystallstrukturer og elektrondensitetsfordeling av etan, etylen og acetylen. Gjenopprettet fra rug.nl
- Nettsteder, G. (s.f.). Etan: Kilder og vasker. Hentet fra sites.google.com
- SoftSchools. (N.d.). Etan Formel. Gjenopprettet fra softschools.com
- Wikipedia. (N.d.). Etan. Hentet fra en.wikipedia.org


