Oppløste egenskaper, forskjeller med oppløst og løsningsmiddel, eksempler
den oppløst stoff, i en løsning,det er stoffet som oppløses i løsningsmidlet. Generelt er løsningen funnet i en mindre andel, og kan være fast, flytende eller gassformig. Tvert imot er løsningsmidlet komponenten av løsningen som er i mer mengde.
For eksempel er salt i saltvann i saltvann og vann er løsningsmidlet. Imidlertid er ikke alle oppløsninger faste eller løsningsmidler væske.

I denne forstand er det flere mulige kombinasjoner av løsemidler og løsemidler: gass i væske, gass i fast væske i væske, flytende i fast stoff, fast i flytende eller fast stoff i fast stoff.
For å gjenkjenne det som er løsningen i en løsning, bør det tas hensyn til to aspekter. For det første er løsningen substansen som er i mindre grad. I tillegg er det den som endrer sin fysiske tilstand (fast, flytende eller gassformig) når den integreres i løsningen.
index
- 1 Løsninger, løsningsmidler og løsemidler
- 2 Definisjon av løsemiddel
- 3 egenskaper
- 3.1 Løselighet
- 3.2 Temperatur
- 3.3 Metning av en løsning
- 3.4 Trykk
- 3,5 polaritet
- 4 Forskjeller mellom løsemiddel og løsningsmiddel
- 5 Eksempler på løsemiddel
- 5.1 Solutos i gassform
- 5.2 Solutos i fast tilstand
- 5.3 Solutos i flytende tilstand
- 5.4 Solutos som kan brukes hjemme
- 6 Referanser
Løsninger, løsemidler og løsemidler
I kjemi er det homogene blandinger, som er de som har sine komponenter delt inn i like store mengder gjennom innholdet. En av de vanligste typene homogene blandinger er løsninger, som er stabile homogene blandinger av to eller flere stoffer, hvor et oppløsningsmiddel oppløses i et løsningsmiddel.
Løsningene, løsningsmidlene og løsningsmidlene blir observert i daglige situasjoner og i et område som varierer fra industri til laboratorium. Disse stoffene dannet fra blandinger er objekter av studie på grunn av egenskapene de presenterer og de krefter og / eller attraksjoner som oppstår mellom dem..
Definisjon av løsemiddel
Som nevnt ovenfor er et løsemiddel den substansen som oppløses i en annen, kalt et løsningsmiddel.
Vanligvis har løsningsmidlet en mindre andel og kan forekomme i noen av de tre tilstandene av materie. Når en løsning blir gitt mellom to stoffer som er i samme fase, brukes metoden for å velge det i en mindre andel å definere som er løsemiddelet og som er løsningsmidlet.
Oppløsningskapasiteten til løsningsmidlet vil bli styrt av oppløseligheten. Temperaturen av løsningsmidlet representerer også en avgjørende faktor når det gjelder å kjenne muligheten for å danne eller ikke en løsning, da jo høyere temperaturen av oppløsningsmidlet er, desto større mengde løsemiddel som kan oppløses i dette.
Det er stoffer som kalles overflateaktive stoffer som blir mindre løselige ved høyere temperaturer, men de er unntak og oppfyller bestemte roller.
Prosessen der et oppløsningsmiddel interagerer med et løsemiddel for å danne en løsning, er definert som solvasjon, og involverer dannelse av bindinger og hydrogenbroer, i tillegg til attraksjonene av van der Waals-styrker.
funksjoner
Løsne stoffene inneholder et enormt utvalg av kjemiske stoffer i forskjellige tilstander, har forskjellige oppløsningskapasiteter og har mange egenskaper som spiller en viktig rolle i dannelsen av homogene blandinger. Noen av de viktigste egenskapene til løsningsmidlene er følgende:
løselighet
Løselighet er evnen til en forbindelse å oppløse i et annet stoff. Denne evnen har et nært forhold til blandbarhet, som er væskens evne til å blande seg med en bestemt; Hvis du ikke kan delta, er det en blandbarhet.
Miscibility har en rekkevidde mer enn et bestemt tall, så det kan sies at ett stoff er helt, delvis eller ikke blandbar i en annen.
Den løsbare egenskapen til et løsemiddel avhenger i sin tur av andre faktorer som kan øke eller redusere denne kapasiteten på grunn av effekten av disse på balansen mellom intermolekylære krefter som oppstår mellom løsemiddel og løsemiddel.
Enda mindre forventede egenskaper, som for eksempel størrelsen på en dråpe løsemiddel eller rekkefølgen i en krystallstruktur, kan påvirke deres evne til å oppløse.
temperaturen
Temperaturen i systemet der et oppløsningsmiddel oppløses kan påvirke dets oppløselighet: for de fleste faste stoffer og væsker øker disse oppløsningskapasiteten i henhold til temperaturen.
I motsetning er det observert en kompleks oppførsel i gassene som vises som en lavere oppløselighet i vann ved høyere temperaturer, men en større i organiske løsningsmidler.
Metting av en løsning
Det kalles metning av en løsning i den grad en løsning har løst oppløsningen, kalt en mettet løsning til det som har oppløst så mye oppløsning som mulig. Fra dette punktet vil det tilsatte løsemiddelet utfelle som et overskudd på bunnen av den brukte beholderen; før dette kalles løsningen umettet.
Det er mulig å passere metningspunktet og fortsette å løse oppløsningen, men dette krever en økning i temperaturen. En løsning som inneholder et overskudd av løsemiddel og som er oppvarmet kalles en overmettet løsning.
trykk
Trykkendringer påvirker vanligvis ikke løseligheten av faste stoffer og væsker, bortsett fra noen unntakstilfeller (kalsiumsulfatakkumulering i petroleumsrør), men i gasser er det en avgjørende faktor for deres evne til å oppløse seg.
Faktisk er løseligheten av en gass i et løsningsmiddel direkte proporsjonal med partialtrykket av den gassen på løsningsmidlet.
polaritet
Polariteten til et løsemiddel er avgjørende for måling av oppløsningskapasiteten sin; et oppløsningsmiddel vil oppløse seg bedre i et løsningsmiddel med en kjemisk struktur som ligner den den har.
For eksempel vil høyt polare eller hydrofile stoffer ha større oppløselighet i høyt polare løsningsmidler, mens de vil være praktisk talt uoppløselige i ikke-polare substanser..
Tilsvarende intermolekylære krefter spiller en viktig rolle i solvatisering, og den letthet med hvilken et oppløsningsmiddel kan oppløse et oppløst materiale: en større dipol-dipol-krefter, hydrogenbindinger og andre bindinger, jo større er muligheten for oppløsningsmidlet for å oppløse løse og danne en løsning.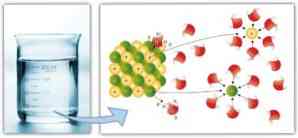
Forskjeller mellom løsemiddel og løsningsmiddel
- Løsemiddelet er stoffet som er oppløst; løsningsmidlet er måten å oppløse løsemiddelet (e).
- Løsningsmidlet kan være i fast, flytende eller gassfase; løsningsmidlet er vanligvis i væskefasen, men det finnes også i fast og gassformig.
- Oppløseligheten av løsningsmidlet avhenger mer av egenskaper som overflaten; Solvatkapasiteten er avhengig av polaritet, temperatur og trykk, blant annet.
- Løsningsmidlet er vanligvis den ønskede komponenten som skal ekstraheres i industrielle prosesser; Oppløsningsmidlet er vanligvis ikke den ønskede komponent og kastes i industrielle prosesser.
Eksempler på løsemiddel
- Sukker er et eksempel på et fastfasestoff, som vanligvis brukes til å søte vann.
- Hexan finnes i parafinvoks, som fungerer som et flytende løsemiddel som gjør dette faste mer smidig.
- Kullsyre er en gass tilsatt til drikker for å gi dem brus.
Solutos i gassform
Kullsyre i vann (brus)
Karbonvann er vann som inneholder karbondioksid og produseres ved å føre karbondioksid under trykk gjennom vann.
Kullsyreholdig mineralvann oppstår naturlig i lang tid. Disse brusende vann eksisterer på grunn av overflødig karbondioksid i en akvifer som har oppløst seg under trykk.
Et av de mest kjente eksemplene på oppløsninger er kommersielle brus, som er kombinert med en sirup.
Tilstedeværelsen av karbondioksid gjør disse vannet og brusen mer appetittvekkende og visuelt tiltalende.
Oksygen og andre gasser i nitrogen (luft)
Luften i atmosfæren består av molekyler av forskjellige gasser. Den består i utgangspunktet av 78% nitrogen og ca. 21% oksygen (løsemiddel). I tillegg inneholder den nesten 1% argon og andre molekyler, men i svært små mengder.
Propan i butan (kokegass)
Denne kombinasjonen, også kjent som flytende petroleumsgass (LPG), begynte å bli brukt siden 1860 som en kilde til drivstoff til hjemmebruk..
Siden da har det utvidet sin produksjon og forbruk for både innenlandsk og industriell bruk. Fordi begge gasser er ekstremt luktfrie og farlige, blir et stoff som heter merkaptan, noe som gjør noe lekkasje merkbart..
Solutos i fast tilstand
Kobber sink (messing)
Den kommersielle legeringen kjent som messing er dannet av sink (fra 5 til 40%) oppløst i kobber. Sink hjelper med å øke strekkstyrken. Andre elementer som tinn, jern, aluminium, nikkel og silisium kan legges til denne legeringen.
Jod i alkohol (tinktur av jod)
Et annet eksempel på solutt populært kjent er jodtinktur. Denne løsningen inneholder jod i etylalkohol (fra 44 til 50%). Jodtinktur brukes som et antiseptisk middel.
Salt i vann (sjøvann)
Sjøvann dekker mer enn 70% av jordens overflate. Dette er en kompleks blanding av 96,5% vann, 2,5% salter og mindre mengder andre stoffer. Dette inkluderer uorganiske og oppløste organiske materialer, partikler og noen atmosfæriske gasser.
Solutos i flytende tilstand
Alkohol i vann (alkoholholdige drikkevarer)
Etanol eller etylalkohol (løsemiddel) fra gjæring av sukker blandes med vann i faste proporsjoner for å produsere alkoholholdige drikker.
Denne forbindelsen blir lett fordøyd av kroppen, men forbruket i overskudd kan forårsake alvorlig helseskade.
Vann i luften (fuktighet i luften)
Vann i luft er vanligvis kjent som tåke. Dette skyldes små dråper vann suspendert i luften, og skyldes i utgangspunktet nedkjøling av jorden om natten.
På denne måten fører denne kjølingen til at omgivende luft senker temperaturen. Deretter oppstår fenomenet når kondensert vann beholdes i dette.
Eddiksyre i vann (eddik)
Eddik er en væske med skarp smak som brukes til å legge til smak eller bevare mat. Den fremstilles ved en oppløsning av eddiksyre blandet med vann.
Konsentrasjonen av eddiksyre er variabel. For eksempel har destillert eddik en andel som går fra 5 til 8%.
Merkur i sølv (amalgam eller tannfyllinger)
Amalgamene som brukes til tannfyllinger, dannes av 2% kvikksølv med en legering som virker som et løsningsmiddel. Denne legeringen inneholder 70% sølv. Du kan også legge tinn, kobber og sink.
Solutos som kan brukes hjemme
Sukker i vann
Sukker er en molekylær og polar forbindelse, og som sådan har evnen til å oppløse i vann, som også er et polart element.
Måten sukker er strukturert på, vil føre til at oppløsningsprosessen varierer. For eksempel, hvis sukkeret er i klumper, vil det ta mer tid å oppløse enn hvis det er i korn.
Noen eksperter mener at vann med sukker er en svært viktig energikilde for kroppen. Det har til og med vært studier som avslører effektiviteten av denne løsningen hos personer som gjør fysisk aktivitet.
Sukker i mel
Det er vanlig å lage en kake for å blande de faste ingrediensene først, deretter tilsett væskene.
Sukker er et løsemiddel som er festet til melet, noe som gir opphav til basisblandingen for kaken. I tillegg til disse to ingrediensene, blir andre tilsatt senere, for eksempel egg, smør eller vanilje.
Denne typen løsemiddel er fast og i dette tilfelle blandes det med et løsningsmiddel som også er fast. Den resulterende basen kan også brukes til å lage søte brød, kaker, kaker, svampekaker, små puddinger og mange andre søte matvarer.
Juice pulver i vann
Det finnes et bredt spekter av pulverisert juice som er tilberedt ved å løse dette elementet i vann. I dette tilfellet er løsningen juicepulveret og løsningsmidlet er vannet.
Mengden oppløsningsmiddel må være større enn det som er oppløst, så vanligvis blir en eller to spiseskje juicepulver oppløst i et glass vann. Selv, det er noen pulvere hvis konsentrasjonen er høyere og en mindre mengde bør brukes.
Det er forstyrrelser av disse saftene, siden de indikerer at komponentene de inkluderer (som konserveringsmidler, stabilisatorer og søtningsmidler, blant andre) er helsefarlige.
Klor i vann
En måte å rense vann på er å bruke klor som et løsemiddel oppløst i vann. Dette desinfeksjonsmiddelet er karakterisert for å være en av de mest brukte for å eliminere mikrober, og det er ideelt å slå ikke-drikkevann i drikkevann på en rask, økonomisk og enkel måte.
Klor som løsemiddel av denne løsningen bør inkorporeres i vann i en konsentrasjon som ikke er høyere enn 0,2 og 0,5 milligram per liter.
Mengden klor som skal brukes, skal være svært lav, fordi dette stoffet kan være ekstremt giftig når det konsumeres eller eksponeres for mange mengder.
Denne metoden for rensing av vann er kjent som klorering, og kan brukes i midten av en ekskursjon til fjellet eller for å behandle vannet i hjemmet, for å eliminere bakterier og mikrober som kan bli funnet i rørene gjennom hvilke vannet passerer..
Maling i vann
Vann er det mest universelle løsningsmidlet som eksisterer, og det er også grunnlaget for at et oppløsningsmiddel som maling kan oppløse.
Malingen oppløses vanligvis av forskjellige grunner. Det vanligste er å legge til rette for rengjøring av børster og andre verktøy som brukes til å male.
Det er mange typer malerier; De som best oppløses i vann er latexene. I tillegg til å gi bedre rengjøring av verktøyene, er fordelen av å fortynne malingen i vann før du begynner å male, at den sikrer en bedre finish på den malte overflaten.
Melkpulver i vann
Melkpulver er et løsemiddel som dannes gjennom dehydrering av melk som allerede er pasteurisert. Formålet med denne prosessen er å sikre at melk kan lagres bedre i lengre tid.
Dette løsemiddel oppløses i vann og genererer flytende melk som vanligvis inntas til frokost, sammen med kaffe eller i forskjellige preparater.
Som i tilfelle av juicepulver, må mengden melk som skal fortynnes være mindre enn mengden vann der du vil forberede løsningen.
Vaskemiddel i vann
Når du vasker klær, brukes væske eller pulvervaskemidler. Disse oppløses i vann for å danne en løsning som fungerer som et desinfeksjonsmiddel og rengjøringsmiddel av tekstilstoffer.
Mengden løsemiddel som må brukes i denne løsningen er variabel, avhengig av type vaskemiddel, presentasjon av det samme og komponentene det har.
Løsningen som består av vaskemiddel og vann kan være svært forurensende når det kommer i kontakt med vanndusker, så det anbefales å bruke bionedbrytbare vaskemidler som kan bli ødelagt på svært kort tid og påvirke mye mindre miljøet.
gelatin
Gelatin er et element som består av sener, ledbånd og dyreknuter. Denne forbindelsen kan være i pulver eller i ark.
I begge tilfeller må dette løsemiddel løses i varmt vann for å oppnå det endelige resultatet: en søt mat som er ideell til en dessert og med mange helsemessige fordeler.
Blant fordelene med denne forbindelsen er at den favoriserer rask vevsreparasjon og er en anti-inflammatorisk mat. I tillegg har den en stor mengde proteiner og spiller en viktig rolle i forsterkningen av immunsystemet.
Å spise en liten daglig mengde gelatin vil bidra til å regenerere leddene og dermed forutse utseendet av osteoporose.
Sjokolade i melk
Sjokolade er et element som dannes takket være blandingen av kakao og kakaosmør. Denne maten fungerer som et løsemiddel når det blandes med melk for å forberede det som er kjent som varm sjokolade.
For dette preparatet oppvarmes den ønskede mengde melk og sjokoladen tilsettes i stykker, i pulver eller væske, kontinuerlig omrøring.
For å løse dette løsningen på best mulig måte og unngå klumpene, er det nødvendig å slå blandingen uten pause.
Kakaopulver i vann
Du kan også tilberede varm sjokolade med kakao. Dette oppløsningen dannes kun av massen av den pulveriserte kakao. I motsetning til sjokolade inkluderer ikke kakao smør av denne frukten.
Kakao kan være helt oppløst i vann for å generere en sjokolade-flavored drink. I disse tilfellene er det viktig å søte blandingen med sukker, honning eller litt søtningsmiddel; ellers blir resultatet ekstremt bitt.
referanser
- Lambert, N. og Mohammed, M. (1993). Kjemi for CXC. Oxford: Heinemann.
- Steen, D. P. (2008). Kullsyre, karbonering og prinsippene for fyllingsteknologi. I D. P. Steen, Philip og P. R. Ashurst (redaktører), Carbonated Soft Drinks: Formulation and Manufacture, pp. 112-143. Oxford: Blackwell Publishing.
- Hva er i luften? (s / f). UCAR senter for vitenskapelig utdanning. Hentet 17. oktober 2017, fra eo.ucar.edu
- Flytende petroleumsgass. (2013, 12. juli). Encyclopædia Britannica.
Hentet 16. oktober 2017, fra britannica.com - Lytle, D. A. og Schock, M. R. (1996). Stagnasjonstid, sammensetning, pH og ortofosfatvirkninger på metallutvasking fra messing. Ohio: U.S. Miljøvernbyrå.
- Crabwee, T. D .; Pelletier, S.J. og Pruett, T. L. (2001). Kirurgisk antisepsis I S. S. Block (redaktør), desinfeksjon, sterilisering og bevaring, pp. 919-934. Philadelphia: Lippincott Williams og Wilkins.
- Byrne, R. H. et al. (2017, juni 07). Sjøvann. Encyclopædia Britannica. Hentet 17. oktober 2017, fra britannica.com
- Plutowska B. og Wardencki, W. (2012). Gasskromatografi-olfaktometri av alkoholholdige drikkevarer. I J. Piggott (redaktør), Alkoholholdige Drikkevarer: Sensorisk Evaluering og Forbrukerforskning, s.101-122. Philadelphia: Woodhead Publishing.
- Hva er tåke? (2017, 12. juli). Met Office (UK). metoffice.gov.uk
- Helmenstine, A. M ... (2016, 16. februar). Hva er den kjemiske sammensetningen av eddik? Hentet 17. oktober 2017, fra thoughtco.com
- Phinney, D.J. og Halstead, J.H. (2017). Tannhjelp: En omfattende tilnærming. Massachusetts: Cengage Learning.
- Britannica, E. (s.f.). Solution-kjemi. Hentet fra britannica.com
- Wikipedia. (N.d.). Oppløselighet. Hentet fra en.wikipedia.org
- Classzone. (N.d.). Løste stoffer. Hentet fra frsd.k12.nj.us
- ChemGuide. (N.d.). Mettede løsninger og oppløselighet. Hentet fra chem.libretexts.org
- Madhusha. (N.d.). Forskjellen mellom løsningsmiddel og løsemiddel. Hentet fra pediaa.com.


