Aluminiumsulfat (Al2 (SO4) 3) struktur, bruk, typer, toksisitet
den aluminiumsulfat er et uorganisk aluminiumsalt med formel Al2(SO4)3, som vanligvis vises som et hvitt fast stoff med skinnende krystaller. Fargen på forbindelsen vil bli påvirket av dens konsentrasjon av jern og annen urenhet. Det finnes to hovedtyper aluminiumsulfat: A og B.
I det nedre bildet vises hvite krystaller av hydratisert aluminiumsulfat. Fraværet av brune farger, som indikerer jernioner i det krystallinske gitteret, kan noteres.

Aluminiumsulfat er et salt som er meget løselig i vann og i naturen er det sjelden å finne det i vannfri form. Det blir vanligvis hydrert i form av oktadekahydratsaluminiumsulfat [Al2(SO4)3.18H2O] eller heksadekahydrat [Al2(SO4)3.16H2O].
På samme måte kan det danne doble salter med kalium og med ammonium, forbindelser kjent som alun. Til dels kan dette skyldes vannets affinitet i hydrater for å beholde andre ioner foruten aluminium.
Aluminiumsulfat kan dekomponeres ved virkning av vann i aluminiumhydroksyd og svovelsyre. Denne egenskapen har tillatt sin bruk som surgjøringsmiddel av jord.
Det er også en giftig forbindelse, spesielt ved kontakt med pulveret. Men det har mange bruksområder og anvendelser varierer fra rensing av vann ved koaguleringsmetoden, til bruk i forskjellige industrier, til deres bruk for terapeutiske formål.
index
- 1 struktur
- 2 Hva er det for (bruker)
- 2.1 Koagulering eller flokkulering av vann
- 2.2 Bruk som mordant av blekk og i utarbeidelse av papir
- 2.3 Industrielle bruksområder
- 2.4 Medisinske og terapeutiske anvendelser
- 2.5 Andre bruksområder
- 3 Produksjon av aluminiumsulfat
- 4 Typer
- 5 Toksisitet
- 6 Referanser
struktur
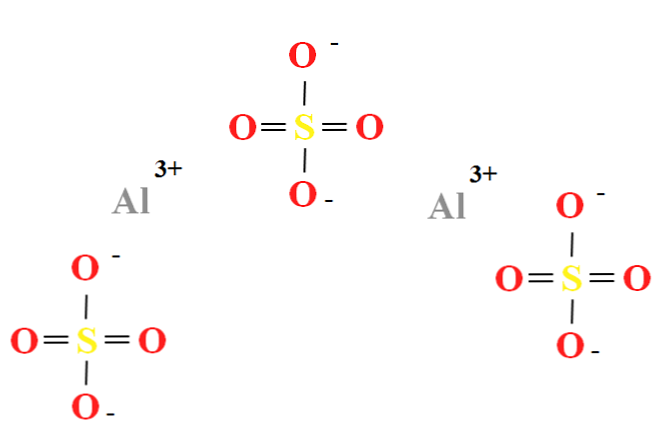
Aluminiumsulfat har et forhold på to Al kationer3+ for hver tredje anion SO42- (toppbilde), som kan observeres direkte i sin kjemiske formel Al2(SO4)3.
Legg merke til at Al3+ de er gråaktige, mens sånn42- de er gule (for svovelatomet) og rødt (for oksygenatomer).
Den illustrerte strukturen tilsvarer den vannfrie form av Al2(SO4)3, siden ingen vannmolekyl samvirker med ioner. I hydrater, kan imidlertid vann bli tiltrukket av de positive sentrene til Al3+, eller av den negative SO tetrahedra42- gjennom hydrogenbindinger (HOH-O-SO32-).
Alen2(SO4)3∙ 18H2Eller, for eksempel, inneholder den 18 vannmolekyler i sin faste struktur. Noen av dem kan være i direkte kontakt med Al3+ eller med SO42-. Med andre ord: aluminiumsulfat kan ha intern eller ekstern koordinasjonsvann.
Dessuten kan dets struktur ta imot andre kationer som Fe3+, na+, K+, etc. Men for dette er det nødvendig med tilstedeværelsen av flere anioner SO42-. For hva? Å nøytralisere økningen i positive kostnader på grunn av metalliske urenheter.
Aluminiumsulfat kan ha mange strukturer, selv om hydratene har en tendens til å adoptere det monokliniske krystallinske systemet.
Fysiske og kjemiske egenskaper
utseende
Det virker som et fast stoff med lyse hvite krystaller, granulater eller pulver.
Molekylvekt
342,31 g / mol (vannfri).
lukt
Det er luktfritt
smaken
Søt smak moderat astringent.
Smeltepunkt
770 ° C vannfri form (86,5 ° C oktadekahydratform)
Løselighet i vann
31,2 g / 100 ml ved 0 ° C; 36,4 g / 100 ml ved 20 ° C og 89 g / 100 ml ved 100 ° C.
tetthet
2,67 til 2,71 g / cm3.
løselighet
Litt oppløselig i etylalkohol.
Damptrykk
Nesten null.
stabilitet
Stabil i luften.
nedbrytning
Ved oppvarming, ved omtrent sitt smeltepunkt, kan den dekomponere ved å emittere spesielt svoveloksyd, en giftig gass.
etse
Aluminiumsulfatløsninger er etsende for aluminium. Også forbindelsen kan korrodere metaller i nærvær av fuktighet.
pKa
3,3 til 3,6. Og dens pH er 2,9 eller mer i en 5% vandig løsning.
Hva er det for (bruker)
Koagulering eller flokkulering av vann
-Når de blandes med vann (drikke serveres eller avfall), stammer aluminiumsulfat aluminiumhydroksyd, som danner kompleks med forbindelsene og partiklene i oppløsning akselerere sedimentering, som i fravær av behandling med aluminiumsulfat ta lang tid.
-Aluminiumsulfat brukes også i rensing av svømmebassengsvann, noe som gjør dem mer attraktive for bruk.
-Ved bruk av aluminiumsulfat blir vann oppnådd uten turbiditet og farge, og øker dens potensialitet ved å lette rengjøring av vann. Dessverre kan denne rensemetoden føre til en noe økt konsentrasjon av aluminium i vannet.
-Aluminium er et meget giftig metall som akkumuleres i hud, hjerne og lunger, forårsaker alvorlige lidelser. I tillegg er det ikke kjent hvilken funksjon den oppfyller i levende vesener.
-EU krever at maksimumsgrensen for aluminium i vann ikke overstiger 0,2 mg / l. I mellomtiden krever US Environmental Protection Agency at maksimumsgrense for vannforurensning med aluminium ikke overstiger 0,05-0,2 mg / l.
-Behandlingen av avløpsvann eller brukt med aluminiumsulfat gjør det mulig å eliminere eller redusere fosfor i dem, økonomisk.
Bruk som mordant av blekk og i utarbeidelse av papir
-Aluminiumsulfat har blitt brukt som en mordant for fargestoffer eller blekk, som bidrar til å fikse på materialet som skal farges. Dens fikseringsvirkning skyldes Al (OH)3, hvis gelatinøse konsistens bidrar til adsorpsjon av fargestoffer på tekstiler.
-Selv om den har blitt brukt siden rundt 2000 f.Kr. for det beskrevne formål, krever bare organiske fargestoffer mordanter. Syntetiske fargestoffer på den annen side krever ikke mordants å oppfylle sin funksjon.
-Den har blitt forskjøvet fra produksjon av papir, men den brukes fortsatt til produksjon av papirmasse. Fjerner urenheter, så vel som har blitt brukt til å binde materialer, nøytralisere ladningene og kalibrere kolofoniumet.
Industriell bruk
-Det brukes i byggebransjen for å akselerere innstillingen av betong. I tillegg er den brukt i vanntettingen av bygninger.
-I såper og fettindustrien brukes den til fremstilling av glyserin.
-Den brukes i oljeindustrien til fremstilling av syntetiske katalysatorer som brukes under drift.
-Det brukes i farmasøytisk industri som en astringent i fremstillingen av medisiner og kosmetikk.
-Intervenerer i produksjon av fargestoffer som karmin. Den brukes også som et fargestoff ved fremstilling av syntetiske gummier av butadienstyren.
-I sukkerindustrien brukes den som melassrenser for sukkerrør.
-Det brukes til fremstilling av deodoranter. Hvorfor? Fordi det forårsaker en innsnevring av kanalene i svettekjertlene, og dermed begrenser opphopningen av svette, et nødvendig medium for vekst av bakterier som forårsaker lukt.
-Den brukes i skinnsanning, den nødvendige prosessen for bruk. I tillegg brukes den til fremstilling av gjødsel.
-Den brukes som tilsetningsstoff ved fremstilling av maling, klebemidler og tetningsmidler, samt rengjørings- og pleieprodukter til møbler..
Medisin og terapeutisk bruk
-Aluminiumsulfat er en immunologisk adjuvans. Derfor, oppfyller den funksjon å behandle antigenene, slik at når den slippes i stedet for aksjon, produserer øket produksjon av antistoffer til antigener som ble inokulert.
-Freunds adjuvans og BCG, og andre hjelpestoffer, blant annet endogent og interleukiner, er ikke-spesifikke overfor antigener, slik at en øket radius av immun handling. Dette har gjort det mulig å utvikle vaksiner mot mange sykdommer.
-Den koagulerende virkningen av aluminiumsulfat har muliggjort eliminering av mange virus i behandlet vann, blant annet: Q beta, MS2, T4 og P1. Resultatene indikerer at behandling av vann med aluminiumsulfat gir en inaktivering av slike virus.
-Aluminiumsulfat brukes i form av pinne eller som pulver ved behandling av små overfladiske sår eller slitasje som produseres ved barbering.
-Det brukes til fremstilling av aluminiumacetat, en forbindelse som brukes til behandling av noen ørebetingelser. Det har også blitt brukt, uten betydelig suksess, for å lindre konsekvensene av brannmyrbitt..
-Løsninger av aluminiumsulfat brukes i en konsentrasjon på 5% til 10% ved lokal behandling av sår som tillater kontroll av deres sekresjoner.
-Den astringente virkningen av aluminiumsulfat kontrakterer de overfladiske lagene i huden, koagulerer proteiner og helbreder sårene.
Andre bruksområder
-Aluminiumsulfat hjelper til med kontroll av overdreven vekst av alger i dammer, innsjøer og i vannstrømmer. Den brukes også til fjerning av bløtdyr, blant annet den spanske sluggen.
-Gartnere bruker denne forbindelsen til å surgere alkaliske jordarter. I kontakt med vannet dannes aluminiumsulfatet i aluminiumhydroksyd og fortynnet svovelsyre. Deretter utfelter aluminiumhydroksidet og etterlater svovelsyren i oppløsning.
-Surgjøring av jord på grunn av svovelsyre, vises i en kreativ måte, på grunn av eksistensen av en plante som kalles Hydrangea, som blomster blir blå i nærvær av en sur jord; det vil si at de er sensitive og reagerer på endringer i pH.
-Aluminiumsulfat er involvert i produksjon av et skum for å bekjempe og kontrollere brann. Hvordan? Reagerer med natriumbikarbonat, som produserer utslipp av CO2. Denne gassen blokkerer O-tilgangen2 til forbrenningsstedet til materialet; og dermed våpenhvilen som utviklet seg.
Produksjon av aluminiumsulfat
Aluminiumsulfat syntetiseres ved å omsette en aluminiumrik forbindelse, slik som bauxittmalm, med svovelsyre ved forhøyede temperaturer. Følgende kjemiske ligning representerer reaksjonen:
til2O3 + H2SW4 -> Al2(SO4)3 + 3 H2O
Aluminiumsulfat kan også dannes ved en nøytraliseringsreaksjon mellom aluminiumhydroksyd og svovelsyre, i henhold til følgende reaksjon:
2 Al (OH)3 + 3 H2SW4 + 12 H2O -> Al2(SO4)3.18H2O
Svovelsyre reagerer med aluminium for å danne ammoniumsulfat og frigjøring av hydrogenmolekyler i form av gass. Reaksjonen er skjematisert som følger:
2 Al + 3 H2SW4 -> Al2(SO4)3 + 3 H2
typen
Aluminiumsulfat er klassifisert i to typer: type A og type B. I aluminiumsulfat type A er faststoffene hvite og har en jernkonsentrasjon på mindre enn 0,5%.
I aluminiumsulfat type B er faststoffene brune og har en jernkonsentrasjon på mindre enn 1,5%.
Det er næringer som produserer aluminiumsulfat som har forskjellige kriterier for klassifisering. En industri rapporterer derfor for sin fremstilling av type A aluminiumsulfat en maksimal konsentrasjon på 0,1% jern som jernoksid. Mens for type B angir de en maksimal jernkonsentrasjon på 0,35%.
toksisitet
-Aluminiumsulfat er en sammensetning som utøver sin giftige virkning ved kontakt med støv, og dermed forårsaker hudirritasjon, og i tilfeller der kontakt er hyppig, er en dermatitt.
-I øynene forårsaker det sterk irritasjon, selv for å produsere permanente skader.
-Innånding forårsaker irritasjon i nese og hals, noe som kan føre til hoste og utslett.
-Dens inntak forårsaker gastrisk irritasjon, kvalme og oppkast.
-Det er toksiske effekter at selv om de ikke er direkte på grunn av aluminiumsulfat, er de indirekte på grunn av deres bruk. Dette er tilfelle av visse toksiske effekter av aluminium, forårsaket av bruk av aluminiumsulfat ved rensing av vann.
-Pasienter som kronisk dialyseres ved hjelp av salter fremstilt i renset vann, ved bruk av aluminiumsulfat, opplever svært alvorlige helsesykdommer. Blant disse lidelsene har vi anemi, demens ved dialyse og økning i bein sykdommer.
referanser
- Wikipedia. (2018). Aluminiumsulfat Hentet fra: en.wikipedia.org
- Aris Industrial Aluminiumsulfatløsning type A og B. Tatt fra: aris.com.pe
- Christopher Boyd (9. juni 2014). Topp industrielle bruksområder for aluminiumsulfat. Tatt fra: chemservice.com
- Pubchem. (2018). Aluminiumsulfat vannfri. Hentet fra: pubchem.ncbi.nlm.nih.gov
- Andesia Chemicals (20. august 2009). Sikkerhetsplate av aluminiumsulfat. [PDF]. Hentet fra: andesia.com
- Kjemisk bok. (2017). Aluminiumsulfat. Tatt fra: chemicalbook.com


