Natriumsulfid Formler, bruk, risiko
den natriumsulfid (Na2S) er et krystallinsk faststoff fra gul til mursteinrød. I naturen finnes det i forskjellige grader av hydrering, som er den vanligste natriumsulfid-nonahydratet (Na2S · 9H2O).
De er vannløselige salter som gir sterkt alkaliske løsninger. Når de blir utsatt for fuktig luft, absorberer de fuktighet fra luften, som kan spontant varme opp og forårsake tenning av nærliggende brennbare materialer. På samme måte, i kontakt med fuktig luft, avgir de hydrogensulfid, som lukter som rotte egg.

De er sterke reduksjonsmidler. Disse stoffene kan være miljøfarlig, spesielt for vannlevende organismer.
Natriummonosulfid er kommersielt tilgjengelig i form av flager inneholdende 60-62% Na2S ...
- formler

- CAS: 1313-82-2 Natriumsulfid (vannfritt)
- CAS: 1313-84-4 Natriumsulfid (ikke-hydrert)
2D struktur
3D-struktur
Kjennetegn ved natriumsulfid
Fysiske og kjemiske egenskaper

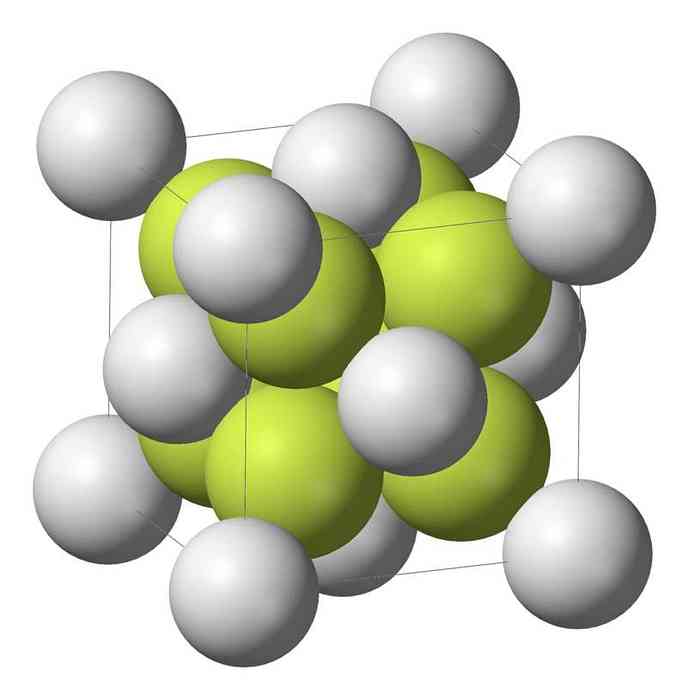
Natrium-monosulfid (Na2S) krystalliserer med antifluorite struktur, hvor hver S-ringatom er omgitt av et nav 8 Na-atomer og hver Na atom med et tetraeder av fire S-atomer.
brennbar
Det eneste svært brennbare elementet i gruppen uorganiske sulfider er hydrogensulfid. Imidlertid kan noen andre uorganiske sulfider, som natriumsulfid, spontant varme opp og til og med antennes hvis de blir utsatt for fuktighet..
Ved eksponering for brann, gir natriumsulfid gasser eller damper av svoveldioksid, som er irriterende eller giftig.
reaktivitet
- Uorganiske sulfider er generelt grunnleggende (noen er sterkt basale og derfor uforenlige med syrer).
- Mange av disse forbindelsene er reduksjonsmidler (de reagerer kraftig med oksidasjonsmidler).
- Sulfider enkle salter (slik som natriumsulfid, kalium og ammonium) reagere kraftig med syrer for å frigjøre hydrogensulfidgass, meget giftig og brennbar.
- Natriumsulfid er brannfarlig. Kan eksplodere når det oppvarmes raskt eller treffer.
- Ved oppvarming til nedbrytning, avgis det giftige damper av natriumoksid og svoveloksider.
- Reagerer voldsomt med karbon, med kull, diazoniumsalter, N, N-diklormetylamin, sterke oksidanter og vann.
toksisitet
Mange medlemmer av gruppen uorganiske sulfider oppfører seg som sterke baser, og kan forårsake alvorlige forbrenninger når de kommer i kontakt med huden.
Denne egenskapen avhenger av dens oppløselighet. De mest uoppløselige uorganiske sulfider (for eksempel kvikksølv (II) sulfid og kadmiumsulfid) er ikke kaustiske.
Natriumsulfid har et oktanol / vann partisjonskoeffisient (Pow) medium (-3,5). Denne verdien brukes som et mål for oppløseligheten (og biokonsentrasjonen) av et stoff i animalske fettvev (spesielt vanndyr).
Natriumsulfid anses å være miljøfarlig, spesielt for vannlevende organismer.
søknader
Hjemme er natrium sulfid brukes i avløp opener, rengjøringsmidler (for ovnen, på badet), rettetang, oppvask såpe og bildeler kollisjonsputer.
I industrien brukes den i rengjøringsmidler, i sement, og som forløper i produksjonen av andre kjemiske produkter.
Kliniske effekter
Eksponering for natriumsulfid er vanlig i utviklede land og underutviklede land, både i industri og hjemme. Disse korrosive stoffene finnes i flere husholdningsvarer i lav konsentrasjon.
I utviklede land er alvorlige effekter sjeldne. Disse forekommer hovedsakelig på grunn av bevisst inntak av kjemikaliet hos voksne. I utviklingsland er imidlertid alvorlige effekter vanligere.
Alkaliske korrosiver forårsaker nekrose på grunn av kondensering. Saponify fettene i cellemembranen, ødelegge cellen og tillate dyp penetrasjon i slimhinnets vev.
Oral eksponering
Initial betennelse oppstår i mage-tarmvevet, etterfulgt av vevnekrose (med mulig perforering), deretter granulasjon og endelig dannelse av stenose.
Pasienter med mildt inntak utvikler irritasjon eller grad jeg brenner (overfladisk hyperemi og ødem) i oropharynx, esophagus eller mage.
Pasienter med moderat forgiftning kan utvikle klasse II-brannsår (overflatiske blærer, erosjoner og sårdannelser) med mulig videre dannelse av stenose (spesielt esophageal).
Noen pasienter (spesielt små barn) kan utvikle ødem i øvre luftveier.
Pasienter med alvorlig oral toksisitet kan utvikle dype brannsår og nekrose av den gastrointestinale mucosa, med komplikasjoner som perforering (øsofageal, gastrisk, duodenal sjelden gang), fistler (trakeo, aortoesophageal) og gastrointestinal blødning.
kan utvikle hypotensjon, tachycardia, tachypné, strikturdannelse (hovedsakelig esophageal), øsofagealt carcinom og ødem i de øvre luftveier (som er vanlig og ofte livstruende).
Alvorlig forgiftning er vanligvis begrenset til bevisst inntak hos voksne.
Eksponering ved innånding
Mild eksponering kan forårsake hoste og bronkospasmer.
Alvorlig innånding kan forårsake øvre luftveier ødem, brannskader, stridor og, sjelden, akutt lungeskade.
Øyeeksponering
Det kan forårsake alvorlig konjunktivirritasjon og kjemose, hornhinneepiteldefekter, limbisk iskemi, permanent visuelt tap og i alvorlige tilfeller av perforering..
Hudkontakt
Mild eksponering forårsaker irritasjon og brannskader med delvis tykkelse. Metabolisk acidose kan utvikles hos pasienter med alvorlige forbrenninger eller sjokk.
Langvarig eksponering eller høy konsentrasjonsprodukter kan forårsake total tykkelse av brann.
Sikkerhet og risiko
Fareuttalelser for det globalt harmoniserte systemet for klassifisering og merking av kjemikalier (SGA)
Globalt Harmonisert System for Klassifisering og merking av kjemikalier (GHS) er en internasjonalt avtalt system, skapt av FN og designet for å erstatte de ulike klassifisering og merking standarder som brukes i forskjellige land ved hjelp av globalt konsistente kriterier.
Fareklasser (og dens tilsvarende kapitlet i GHS) klassifisering standarder og merking og anbefalinger for natriumsulfid er (European Chemicals Agency, 2017, FN, 2015; pubchem, 2017):







referanser
- Benjah-bmm27, (2006). Fluoritt-enhet-celle-3D-ionisk [bilde] Hentet fra: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [bilde] Hentet fra: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D struktur av 1313-82-2 - Natriumsulfid [bilde] Hentet fra: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-struktur av 1313-84-4 - Natriumsulfid [bilde] Hentet fra: chem.nlm.nih.gov.
- European Chemicals Agency (ECHA). (2017). Sammendrag av klassifisering og merking.
- Harmonisert klassifisering - Vedlegg VI til forordning (EF) nr. 1272/2008 (CLP-forskrift). Natriumsulfid. Hentet 16. januar 2017, fra: echa.europa.eu.
- European Chemicals Agency (ECHA). (2017). Sammendrag av klassifisering og merking.
- Meldepliktig klassifisering og merking. Natriumsulfid, hydrert. Hentet 16. januar 2017, fra: echa.europa.eu.
- Datablad for farlige stoffer (HSDB). TOXNET. (2017). Natriumsulfid. Bethesda, MD, EU: National Library of Medicine. Hentet fra: toxnet.nlm.nih.gov.
- Lange, L., og Triebel, W. (2000). Sulfider, polysulfider og sulfaner. I Ullmanns Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. Hentet fra dx.doi.org.
- De forente nasjoner (2015). Globalt harmonisert system for klassifisering og merking av kjemiske produkter (SGA) sjette revidert utgave. New York, USA: FNs publikasjon. Hentet fra: unece.org.
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database. (2016). Sodium Sulfide Enneahydrate - PubChem Structure [bilde] Hentet fra: pubchem.ncbi.nlm.nih.gov.
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database. (2017). Natriummonosulfid. Bethesda, MD, EU: National Library of Medicine. Hentet fra: pubchem.ncbi.nlm.nih.gov.
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database. (2017). Natriumsulfid enneahydrat. Bethesda, MD, EU: National Library of Medicine. Hentet fra: pubchem.ncbi.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Kjemisk datablad. Natriumsulfid, vannfri. Silver Spring, MD. EU; Hentet fra: cameochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Reaktivt gruppe dataark. Sulfider, Uorganisk. Silver Spring, MD. EU; Hentet fra: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [bilde] Hentet fra: wikipedia.org.
- PubChem, (2016). Natriummonosulfid [bilde] Hentet fra: puchem.nlm.nih.gov.
- PubChem, (2016). Sodium Sulfide enneahydrate [image] Hentet fra: puchem.nlm.nih.gov.
- Wikipedia. (2017). Octanol-vann partisjonskoeffisient. Hentet 17. januar 2017, fra: wikipedia.org.
- Wikipedia. (2017). Natriumsulfid. Hentet 17. januar 2017, fra: wikipedia.org.


