Theory of the Sea of Electron Fundamentals, egenskaper og ulemper
den elektronsteori om elektroner Det er en hypotese som forklarer et eksepsjonelt kjemisk fenomen som oppstår i metallbindinger mellom elementer med lave elektronegativiteter. Det handler om deling av elektroner mellom forskjellige atomer knyttet til metallobligasjoner.
Den elektroniske tettheten mellom disse koblingene er slik at elektronene blir delokalisert og danner et "hav" hvor de beveger seg fritt. Det kan også uttrykkes ved kvantemekanikk: noen elektroner (vanligvis en til syv per atom) er arrangert i orbitaler med flere sentre som strekkes over metalloverflaten.
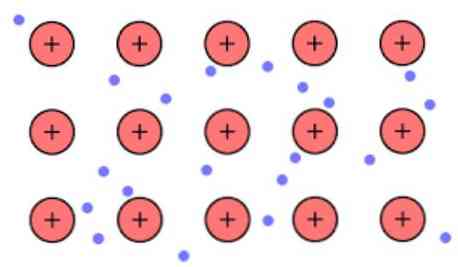
Også elektroner beholder noe sted i metallet, selv om sannsynlighetsfordelingen av det elektroniske skyet har høyere tetthet rundt noen bestemte atomer. Dette skyldes at når de påfører en viss strøm, viser de konduktiviteten i en bestemt retning.
index
- 1 Grunnlag for teorien om havet av elektroner
- 2 Egenskaper
- 2.1 Offset i form av lag
- 2.2 Teorien om havet av elektroner i metalliske krystaller
- 3 Ulemper med teorien
- 4 referanser
Grunnleggende om teorien om havet av elektroner
De metalliske elementer har en større tendens til å donere elektroner til den siste energinivå (valens skall), på grunn av sin lave ioniseringsenergi i forhold til de andre elementer.
Å vite dette kan hvert metallelement betraktes som en kation knyttet til elektronen i sitt siste energinivå, noe som ville være mer tilbøyelig til å donere.
Som et metall som har et stort antall atomer som er koblet sammen, kan det antas at metallet danner en gruppe av metallkationer som er neddykket i en slags sjø av valenselektroner som har en stor delokalisering.
Mens de elektrostatiske tiltrekningskrefter mellom kationet (positiv ladning) og elektron (negativ ladning) har metallatomer bundet sterkt forestiller delokalisering av valenselektronene oppfører seg som en elektrostatisk klebende beholder koblet til metallkasjonene.
Dermed kan det utledes at jo større antallet av elektroner i valensen skall av et metall, vil denne arten elektrostatiske klebefasthet.
egenskaper
Teorien om havet av elektroner gir en enkel forklaring på egenskapene til metalliske arter som motstand, ledningsevne, duktilitet og smidbarhet, som varierer fra ett metall til en annen.
Det har vist seg at motstanden overføres til de store delokalisering metaller med elektroner må, som genererer en høy kohesjon kraft mellom atomene som utgjør.
På denne måten er duktilitet kjent som evnen til visse materialer til å tillate deformasjon av deres struktur uten å gi nok til å bryte, når de blir utsatt for visse krefter.
Offshoring i form av lag
Både god duktilitet og smibarhet metall de er bestemt ved det faktum at valenselektronene er delokalisert i alle retninger i lag, noe som får dem til å bevege seg over hverandre mot virkningen av en ytre kraft, unngå å bryte metallstrukturen, men tillate deformasjonen.
Også bevegelsesfrihet gjør det mulig med delokaliserte elektroner som kan være en strøm av elektrisk strøm, forårsaker metaller med god elektrisk ledningsevne.
I tillegg tillater dette fenomenet fri bevegelse av elektroner overføringen av kinetisk energi mellom de forskjellige områdene av metallet, som fremmer overføring av varme og forårsaker at metaller manifesterer en høy varmeledningsevne.
Teorien om havet av elektroner i metalliske krystaller
Krystaller er faste stoffer som har fysiske og kjemiske egenskaper - som tetthet, smeltepunkt og hardhet - som er opprettet av den slags krefter som gjør partiklene som gjør dem til å bli sammen.
På en måte anses det at krystallene av metalltype har de enkleste strukturer, fordi hvert "punkt" av krystallnettverket har vært okkupert av et atom av metallet selv.
På samme måte har det blitt fastslått at strukturen av metallkrystallene generelt er kubisk og fokuserer på ansiktene eller kroppen.
Imidlertid kan disse artene også være sekskantet i form og ha en ganske kompakt pakning, noe som gir dem den enorme tettheten som er karakteristisk.
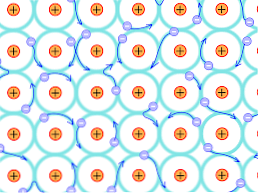
På grunn av denne strukturelle grunnen er bindingene som dannes i metallkrystallene forskjellige fra de som forekommer i de andre typer krystaller. Elektronene som kan danne bindinger delokaliseres gjennom den krystallinske strukturen, som forklart ovenfor.
Ulemper med teorien
I metalliske atomer er det en liten mengde valenselektroner i forhold til deres energiske nivåer; det vil si at det er en større mengde tilgjengelige energistater enn mengden elektroner som er koblet sammen.
Dette innebærer at når det er en sterk elektron delokalisering og energibånd som har fylt delvis, kan elektronene bevege seg gjennom gitterstrukturen når den utsettes for fra det elektriske felt fra utsiden, i tillegg danner havet elektron som støtter permeabiliteten til nettverket.
Slik at metallbindende blir tolket som en klynge av positivt ladede ioner kombinert med et hav av elektroner (negativ ladning).
Det er imidlertid funksjoner som ikke kan forklares ved denne modellen, som dannelsen av visse legeringer med spesielle sammensetninger fra metaller eller metalliske bindinger kollektiv stabilitet, blant annet.
Disse ulempene er forklart av kvantemekanikk, fordi det er etablert både denne teorien mange andre tilnærminger basert på den enkleste modellen av et enkelt elektron, mens du prøver å gjelde i mer komplekse strukturer av multielectron atomer.
referanser
- Wikipedia. (2018). Wikipedia. Hentet fra en.wikipedia.org
- Holman, J. S. og Stone, P. (2001). Kjemi. Hentet fra books.google.co.ve
- Parkin, G. (2010). Metal-Metal Bonding. Hentet fra books.google.co.ve
- Rohrer, G. S. (2001). Struktur og binding i krystallinske materialer. Hentet fra books.google.co.ve
- Ibach, H. og Lüth, H. (2009). Solid State Physics: En introduksjon til Material Science. Hentet fra books.google.co.ve


