Karbonatomskarakteristikker, struktur, hybridisering, klassifisering
den karbonatom Det er kanskje det viktigste og symbolske for alle elementene, fordi takket være det er livets eksistens mulig. Det omslutter i seg selv ikke bare noen få elektroner, eller en kjerne med protoner og nøytroner, men også stjernestøv, som til slutt innlemmes og danner levende vesener.
Også, karbonatomer, er i jordskorpen, men ikke sammenlign overflod metalliske elementer, som jern, karbonater, karbondioksid, olje, diamanter, karbohydrater, etc., er en del av dets fysiske og kjemiske manifestasjoner.
Men hvordan er karbonatomet? En første unøyaktig skisse er den som observeres i bildet ovenfor, hvis egenskaper er beskrevet i det følgende avsnitt.
Kullatomer reiser gjennom atmosfæren, havene, undergrunnen, plantene og alle dyrearter. Dens store kjemiske mangfold er på grunn av den høye stabiliteten til koblingene og hvordan de bestilles i rommet. Dermed har den på den ene siden det glatte og smørende grafittet; og på den andre, diamanten, hvis hardhet overgår det av mange materialer.
Dersom det karbonatom ikke ha de egenskaper som karakteriserer, organisk kjemi finnes ikke helt. Noen visjonære ser ham som den nye materialer i fremtiden, gjennom design og funksjonalisering av sine allotropic strukturer (karbon nanorør, graphene, fullerener, etc.).
index
- 1 Karakteristikk av karbonatomet
- 2 struktur
- 3 Hybridisering
- 3,1 sp3
- 3,2 sp2 og sp
- 4 Klassifisering
- 4.1 Primær
- 4,2 sekundær
- 4.3 Tertiær
- 4.4 Kvartær
- 5 bruksområder
- 5.1 Atommasseenhet
- 5.2 Karbon syklus og liv
- 5.3 13C NMR spektroskopi
- 6 Referanser
Karakteristika av karbonatomet
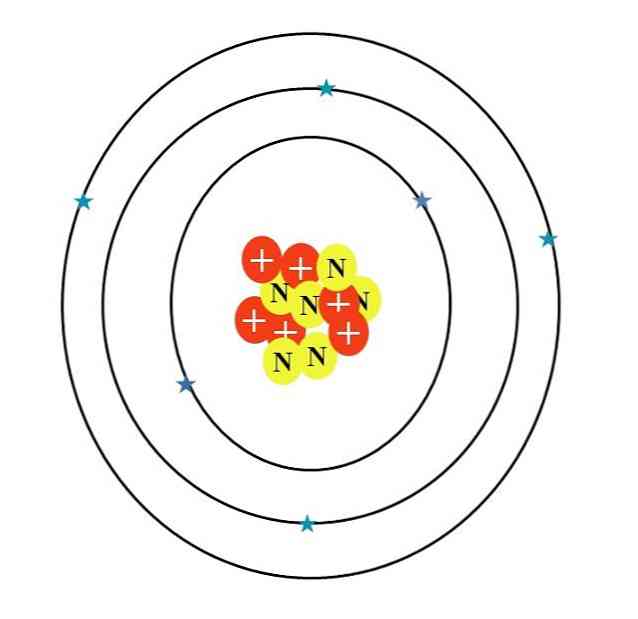
Karbonatomet er symbolisert ved bokstaven C. atomtall Z er 6, derfor, har seks protoner (røde sirkler med symbolet "+" i kjernen). Det har også seks nøytroner (gule sirkler med bokstaven "N") og til slutt seks elektroner (blå stjerner).
Summen av massene av deres atompartikler gir en gjennomsnittsverdi på 12,0107 u. Atomet i bildet tilsvarer 12-karbonisotopen (12C), som består av d. Andre isotoper, for eksempel 13C og 14C, mindre rikelig, varierer bare i antall nøytroner.
Så, hvis du tegner disse isotoper på 13C ville ha en ekstra gul sirkel, og 14C, to flere. Dette betyr logisk at de er tyngre karbonatomer.
I tillegg til dette, hvilke andre karakteristikker kan nevnes i denne forbindelse? Det er tetravalent, det vil si, det kan danne fire kovalente bindinger. Den ligger i gruppe 14 (MVA) av periodisk tabell, nærmere bestemt i blokk p.
Det er også et meget allsidig atom, som kan knytte sammen med nesten alle elementene i det periodiske bordet; spesielt med seg selv, danner makromolekyler og lineære, forgrenede og lamellære polymerer.
struktur
Hva er strukturen av et karbonatom? For å svare på dette spørsmålet må du først gå til din elektroniske konfigurasjon: 1s22s22p2 eller [He] 2s22p2.
Derfor er det tre orbitaler: 1s2, de 2s2 og 2p2, hver med to elektroner. Dette kan også sees i bildet ovenfor: tre ringer med to elektroner (blå stjerner) hver (for ikke å forvirre de ringer baner: er orbitaler).
Vær imidlertid oppmerksom på at to av stjernene har en mørkere nyanse av blå enn de andre fire. Hvorfor? Fordi de to første tilsvarer det indre laget 1s2 eller [Han], som ikke deltar direkte i dannelsen av kjemiske bindinger; mens elektronene i ytre lag, 2s og 2p, gjør.
S- og p-orbitalene har ikke samme form, så det illustrerte atomet er ikke i samsvar med virkeligheten; i tillegg til den store disproportjonen av avstanden mellom elektronene og kjernen, som bør være hundrevis av ganger større.
Derfor består karbonatomets struktur av tre orbitaler hvor elektronene "smelter" inn i diffunderte elektroniske skyer. Og mellom kjernen og disse elektronene er det en avstand som gjør at vi kan se den enorme "tomheten" inne i atomet.
hybridisering
Det ble tidligere nevnt at karbonatomet er tetravalent. Ifølge sin elektroniske konfigurasjon er dets 2-elektroner paret og 2p-elektronene er uparret:
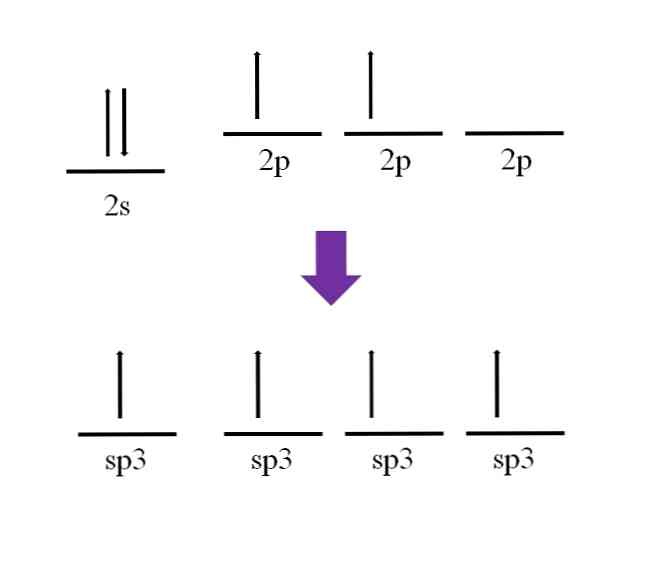
Det er fortsatt en tilgjengelig p-orbit, som er tom og fylt med en ekstra elektron i nitrogenatomet (2p3).
Ifølge definisjonen av kovalentbinding er det nødvendig at hvert atom bidrar til en elektron for dens dannelse; Imidlertid kan det observeres at i basal tilstand av karbonatomet, har det knapt to uparbeide elektroner (en i hver 2p-bane). Dette betyr at i denne tilstanden er det et divalent atom, og derfor danner det bare to bindinger (-C-).
Så, hvordan er det mulig at karbonatomet danner fire obligasjoner? For å gjøre dette må du markedsføre et elektron fra 2s-banen til 2p høyere energibane. Dette gjøres, de fire resulterende orbitaler er degenerert; med andre ord, de har samme energi eller stabilitet (merk at de er justert).
Denne prosessen er kjent som hybridisering, og takket være det, har karbonatomet nå fire orbitale sp3 med en elektron hver for å danne fire koblinger. Dette skyldes at det er karakteristisk for å være tetravalent.
sp3
Når karbonatomet har en sp hybridisering3, Orienter sine fire hybrid-orbitaler til toppene av en tetraeder, som er dens elektroniske geometri.
Så, du kan identifisere en carbon sp3 fordi det bare danner fire enkle bindinger, som i metanmolekylet (CH4). Og rundt dette kan man observere et tetrahedral miljø.
Overlappingen av sp orbitals3 Den er så effektiv og stabil at den enkle C-C-bindingen har en entalpi på 345,6 kJ / mol. Dette forklarer hvorfor det finnes endeløse karbonholdige strukturer og et umåtelig antall organiske forbindelser. I tillegg til dette kan karbonatomer danne andre typer bindinger.
sp2 og sp
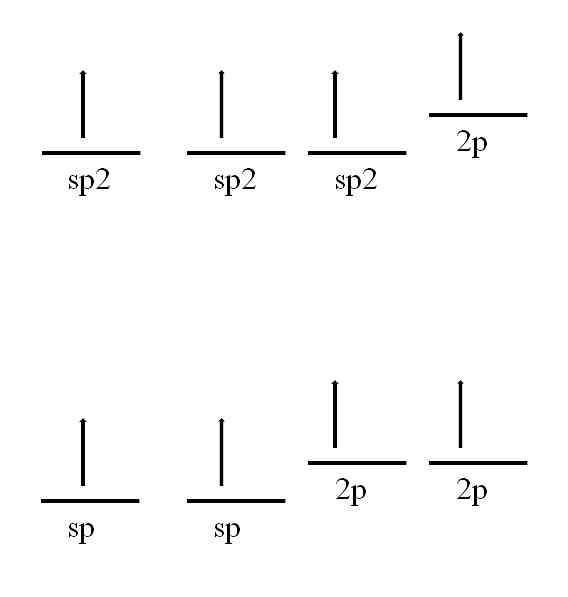
Karbonatomet er også i stand til å vedta andre hybridiseringer, noe som vil tillate det å danne en dobbelt eller enda trippelbinding.
I sp hybridisering2, Som det er sett på bildet, er det tre sp orbitaler2 degenerert og en 2p bane forblir uendret eller "ren". Med de tre sp orbitalene2 separert 120º, karbonet danner tre kovalente bindinger ved å tegne en trigonalplan elektronisk geometri; mens det med 2p-bane, vinkelrett mot de andre tre, danner det en binding π: -C = C-.
I tilfelle av hybridisering sp sp orbital to 180 ° fra hverandre, slik at det trekker en lineær elektron geometri. Denne gangen, har to rene 2p orbitaler vinkelrett på hverandre, noe som tillater at karbon danner trippelbindinger, eller to dobbeltbindinger: eller -C = C ·· C = C = C ·· (det sentrale karbon ha sp hybridisert ).
Merk at alltid (vanligvis) hvis du legger til koblingene rundt karbonet, finner du at tallet er lik fire. Denne informasjonen er viktig når du tegner Lewis strukturer eller molekylære strukturer. Et karbonatom som danner fem bindinger (= C≡C) er teoretisk og eksperimentelt uopptakelig.
klassifisering
Hvordan klassifiseres karbonatomer? Mer enn en klassifisering av interne egenskaper, er det i realiteten avhengig av molekylmiljøet. Det vil si at i et molekyl kan dets karbonatomer klassifiseres i henhold til følgende.
hoved~~POS=TRUNC
En primær karbon er en som kun er koblet til et annet karbon. For eksempel, etanets, CH3-CH3 består av to sammenbundne primære karboner. Dette signaliserer slutten eller begynnelsen av en karbonkjede.
sekundær
Det er en som er knyttet til to karbonatomer. Så, for propanmolekylet, CH3-CH2-CH3, karbonatomet i mediet er sekundært (metylengruppen, -CH2-).
tertiære
De tertiære karbonene adskiller seg fra resten fordi de kommer fra grener av hovedkjeden. For eksempel er 2-metylbutan (også kalt isopentan), CH3-CH(CH3) -CH2-CH3 Den har et tertiært karbon uthevet med fet skrift.
kvartær
Og til slutt er de kvaternære karbonene, som navnet antyder, knyttet til fire andre karbonatomer. Neopentanmolekylet, C(CH3)4 har et kvaternært karbonatom.
søknader
Atommasseenhet
Den gjennomsnittlige atommassen på 12C brukes som standardmål for beregning av massene til de andre elementene. Således veier hydrogen en tolvte av denne karbonisotopen, som brukes til å definere det som er kjent som atommasse enhet u.
Dermed kan de andre atommassene sammenlignes med 12C og 1H. for eksempel magnesium (24Mg) veier omtrent dobbelt så mye som et karbonatom, og 24 ganger mer enn et hydrogenatom.
Carbon syklus og liv
Planter absorberer CO2 i prosessen med fotosyntese for å frigjøre oksygen til atmosfæren og fungere som plantelunger. Når de dør, blir de trekull, som etter brenning frigjør CO2. En del kommer tilbake til plantene, men en annen ender opp i sjøsenger, nærer mange mikroorganismer.
De mikroorganismer dør, det resterende faste sedimenterte sin biologisk nedbrytning, og etter millioner av år, blir det som kalles olje.
Når menneskeheten bruker denne oljen som en alternativ energikilde til kullforbrenning, bidrar det til utslipp av mer CO2 (og andre uønskede gasser).
På den annen side bruker livet karbonatomer fra de dypeste grunnlagene. Dette skyldes stabiliteten av bindingene, som gjør det mulig å danne kjeder og molekylære strukturer som utgjør makromolekyler like viktige som DNA.
NMR-spektroskopi 13C
den 13C, selv om det er i en mye mindre andel enn det av 12C, dens overflod er tilstrekkelig til å belyse molekylære strukturer gjennom karbon-13-kjernemagnetisk resonansspektroskopi.
Takket være denne analyseteknikken kan det bestemmes hvilke atomer som omgir 13C og hvilke funksjonelle grupper de tilhører. Dermed kan karbonskjelettet av en hvilken som helst organisk forbindelse bestemmes.
referanser
- Graham Solomons T.W., Craig B. Fryhle. Organisk kjemi. Aminer. (10. utgave.) Wiley Plus.
- Blake D. (4. mai 2018). Fire karakteristika av karbon. Hentet fra: sciencing.com
- Royal Society of Chemistry. (2018). Carbon. Tatt fra: rsc.org
- Forstå evolusjonen. (N.d.). Journey of a carbon atom. Hentet fra: evolution.berkeley.edu
- Encyclopædia Britannica. (14. mars 2018). Carbon. Hentet fra: britannica.com
- Pappas S. (29. september 2017). Fakta om karbon. Hentet fra: livescience.com


