Manganoksyd (MnO2) Kjemisk struktur, egenskaper og bruksområder
den manganoksyd (MnO2) Er et uorganisk kjemisk forbindelse som består av mangan element med en 4 oksidasjonstall og oksygen i oksyddannelse den har et oksidasjonstall på -2. Det er også kjent med navnene på mangan (IV) oksid og mangananhydrid.
Det er et fast stoff fra mørk til svart kaffe. Det er i naturen som mineralpirolusitt, svarte og krystalliserte formende dendriter (forgrenede forlengelser). Det kan oppnås som et svart rest i reaksjonen mellom etylen og kaliumpermanganat etter dannelse av glykol ved den oksyderende virkning av kaliumpermanganat.

Det er meget viktig i glassindustrien på grunn av sin natur av oksidasjonsmiddel, eliminerer den grønne fra jernforbindelser og omdanner treverdig.
index
- 1 Kjemisk struktur
- 2 Egenskaper
- 3 bruksområder
- 3.1 Som katalysator
- 4 Virkninger på helse
- 5 referanser
Kjemisk struktur
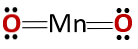
Den kjemiske struktur av forbindelsen som svarer til den av et anhydrid, og ikke av et basisk oksid, som forventet ved være dannet av et metall og et ikke-metall.
Dette spesielle tilfellet skyldes atferden som mangan antar i de forskjellige oksydasjonstilstandene den har. Dermed for oksidasjonstilstandene +2 og +3 danner oksidene MnO og Mn2O3 henholdsvis at de danner henholdsvis manganhydroksid og manganhydroksyd når de reagerer med vann.
Imidlertid er Mn2O3 i et litt surt medium oppfører det seg som et anhydrid. Med oksidasjonstilstandene +4, +6 og +7, MnO2, MnO3 og MnO4 de danner syrer når de reagerer med vann.
I et litt surt medium, MnO2 Den oppfører seg som et grunnleggende oksyd, slik at det kan danne det tilsvarende hydroksidet.

Det må huskes at i dette tilfellet ikke er nevnt amfoteriske egenskaper, ifølge hvilke en forbindelse kan oppføre seg som en syre eller som en base. Dette er et spesielt tilfelle av Mn-oppførsel.
egenskaper
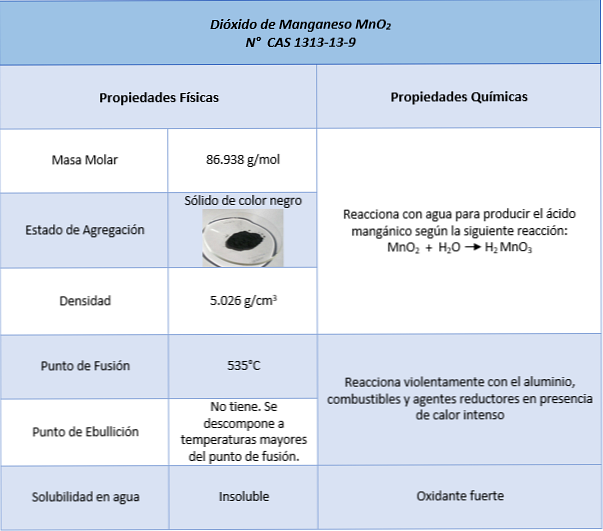
søknader
- Det brukes som kilde til mangan
- Som oksidant i alkaliske batterier
- Maling til glass, keramikk og porselen.
- Ved oppnåelse av klor og jod.
- Ved dekomponering av hydrogenperoksid for dannelse av gassformig oksygen og vann.
- I dekomponeringsreaksjonen av kaliumklorat for produksjon av gassformig oksygen og kaliumklorid.
- Oppløses i aceton eller i diklormetan, oksiderer primære alkoholer til aldehyder og sekundærer til ketoner.
- Produksjon av alkaliske batterier.
Som katalysator
Dette gjelder oksydreduksjonsreaksjoner, for fjerning av sulfider som H2S og kasjoner som Fe+2 og Mn+2 , arsen og radio funnet i grunnvann som er forurenset av denne typen forbindelser.
Denne forurensning kan frembringes enten ukontrollert dumping av giftige materialer, ved vasking av kontaminert jord eller ved nærvær av kjemiske elementer ved vannekstraksjonen.
MnO2 Høy renhet oppnådd fra pyrolusitt som brukes som filter (Filox) er den mest effektive måten å fjerne denne klassen av urenheter fra grunnvannet.
Virkninger på helse
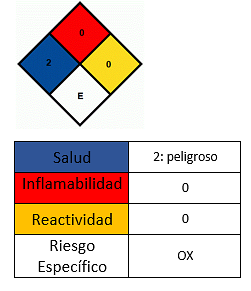
- Unngå kontakt med huden.
- Ved kontakt, vask det tilsvarende området.
- Ikke inhaler pulveret.
- Irritasjon og rødhet kan ses ved øyekontakt. Vask med rikelig med vann, la vannet løpe gjennom øynene og ring for medisinsk hjelp i tilfelle alvorlig.
- I kontakt med huden blir irritasjon og rødhet observert. Vask det berørte området med rikelig med vann og såpe.
- Langvarig hudkontakt fjerner ditt naturlige fett, utløser en dermatitt.
- Innånding kan forårsake en influensalignende tilstand (metalliske røyk). Tilstanden er preget av høy feber, kulderystelser, tørr munn og hals, muskel smerte og hodepine.
- Det kan irritere luftveiene og øke forekomsten av luftveisinfeksjoner (lungebetennelse). Intoksikasjon ved absorpsjon av uorganiske mangansalter gjennom lungene er usannsynlig, men kronisk forgiftning kan forekomme.
- Kronisk eksponering for støv eller røk mangandioksyd i løpet av en lang periode kan påvirke sentralnervesystemet og stimulere utviklingen av en i likhet med Parkinsons sykdom, vanskeligheter med å gå, muskelkramper og adferdsendringer.
- Svelging kan forårsake magesmerter og kvalme.
- Det er ikke brannfarlig, men det bidrar til å spre brannen i glødelamper. Ved oppvarming til en temperatur over 535 ° C nedbrytes stoffet til manganoksyd (III) Mn2O3 og oksygen, som er brannfarlig og øker faren for brann. I så fall skal brannen slokkes med skum eller karbondioksid.
- Ved spilling må ikke stoffet manipuleres uten riktig personlig beskyttelse.
- Oppbevar forbindelsen i tett lukkede beholdere på et kaldt og tørt sted og borte fra uforenlige stoffer som organisk materiale og brennbart materiale.
- Oppbevaringsstedet må være tørt og ha gulv motstandsdyktig mot syrekorrosjon og med god drenering..
- Personlig verneutstyr bør brukes, for eksempel hansker, vernebriller, antistøvmasker, støv og røyk.
referanser
- B, (2015), Mangandioxid, The Royal Society of Chemistry - Kjemisk verden, hentet fra chemistryworld.com
- Karal, (2014), mangnesondioksyd, sikkerhetsdatablad, gjenopprettet fra, karal.com.mx
- Din virtuelle lærer (2/25/2015). Mangan uorganiske forbindelser (spesielle tilfelle 1) - Teoretisk leksjon), hentet fra, youtube.com
- Ecured, (s.f), mangandioxid, gjenvunnet fra ecured.cu
- Angarita G, Johnny., (2017), Mangandioxid: En Eksepsjonell Teknologi. Hidroteco, utvinnes fra hydrotecocr.com
- Fernández, G., (2015), MnO mangandioxid2/ aceton, Organisk kjemi, Gjenopprettet fra quimicaorganica.net
- Tronox, (2011), mangandioxid, sikkerhetsdatablad, gjenopprettet fra, tronox.com


