Sølvoksyd (Ag2O) struktur, egenskaper, nomenklatur og bruk
den sølvoksid er en uorganisk forbindelse hvis kjemiske formel er Ag2O. Kraften som forener dets atomer er av en helt ionisk natur; derfor består den av et ionisk faststoff hvor det er et forhold på to Ag kationer+ interagerer elektrostatisk med en anion O2-.
Oksydanionen, O2-, det resulterer fra samspillet mellom sølvatomer i overflaten med oksygen av miljøet; på en veldig lignende måte som jern og mange andre metaller. En sølvbit eller smykker i stedet for rødme og smuldre i rust, blir svart, karakteristisk for sølvoksid.

For eksempel, i bildet ovenfor kan du se en rusten sølvkopp. Legg merke til dens svarte overflate, selv om den fremdeles beholder noen dekorativ glans; Derfor kan selv rustne sølvobjekter betraktes som attraktive nok til dekorative bruksområder.
Egenskapene til sølvoksid er slik at de ikke ved første øyekast ødelegger den opprinnelige metalliske overflaten. Den dannes ved romtemperatur ved enkel kontakt med oksygen i luften; og enda mer interessant, kan det dekomponere ved høye temperaturer (over 200 ° C).
Dette betyr at hvis glasset på bildet er fanget, og han benyttet varmen av en intens flamme, gjenvinne sin sølvglitter. Derfor er dens dannelse en termodynamisk reversibel prosess.
Sølvoksid har også andre egenskaper, og utover den enkle Ag-formelen2Eller det omfatter komplekse strukturelle organisasjoner og et rikt utvalg av faste stoffer. Imidlertid er Ag2Eller er det kanskje, ved siden av Ag2O3, den mest representative for oksider av sølv.
index
- 1 Struktur av sølvoksid
- 1.1 Endringer med antall valencia
- 2 Fysiske og kjemiske egenskaper
- 2,1 Molekylvekt
- 2.2 Utseende
- 2.3 tetthet
- 2.4 Smeltepunkt
- 2,5 kps
- 2.6 Løselighet
- 2.7 Kovalent karakter
- 2,8 nedbrytning
- 3 Nomenklatur
- 3.1 Valencias I og III
- 3.2 Systematisk nomenklatur for komplekse sølvoksyder
- 4 bruksområder
- 5 referanser
Struktur av sølvoksid
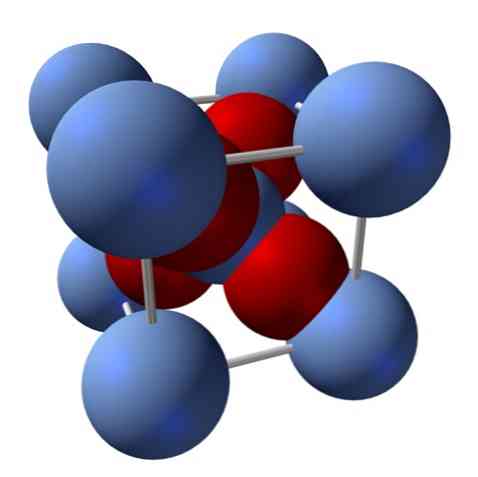
Hvordan er dens struktur? Som nevnt i begynnelsen: Det er et ionisk faststoff. Av denne grunn kan det ikke være kovalente bindinger Ag-O eller Ag = O i sin struktur; siden, hvis det var, ville egenskapene til dette oksydet endre seg drastisk. Det er da Agioner+ og O2- i et forhold på 2: 1 og opplever en elektrostatisk tiltrekning.
Sølvoksydets struktur bestemmes som følge av den måten de ioniske kreftene disponerer i rommet Ag-ionene+ og O2-.
I det øvre bildet, for eksempel, har du en enhetscelle for et kubisk krystallinsk system: Ag kasjonene+ er sølvblå sfærer og O2- de rødlige kulene.
Hvis du teller antall sfærer, vil du oppdage at det ved første øyekast er ni av sølvblå og fire røde farger. Imidlertid tas kun fragmentene av kulene inne i terningen hensyn til; av å telle disse, som er fraksjoner av de totale sfærene, må forholdet 2: 1 for Ag må oppfylles2O.
Gjenta strukturenheten av AgO tetraederen4 omgitt av fire andre Ag+, alt det svarte faststoffet er bygget (unngår hullene eller uregelmessighetene som disse krystallarrangementene kan ha).
Endringer med antall valencia
Fokuserer nå ikke på AgO tetraederen4 men i AgOAg linje (se toppunktene av den øvre nav), vil ha den faste sølvoksyd består, fra et annet perspektiv, flerlags ion lineært arrangerte (selv om tilbøyelig). Alt dette som et resultat av "molekylær" geometri rundt Ag+.
Ovennevnte har blitt styrket av flere studier av sin ioniske struktur.
Sølv fungerer hovedsakelig med valens +1, siden når man mister et elektron, er den resulterende elektroniske konfigurasjonen [Kr] 4d10, som er veldig stabil. Andre valenser, som Ag2+ og Ag3+ de er mindre stabile siden de taper elektroner fra orbitaler nesten fullstendig fylt.
The Ag ion3+, Det er imidlertid relativt mindre ustabil enn Ag2+. Faktisk kan det eksistere i samarbeid med Ag+ Kjemisk berikende strukturen.
Den elektroniske konfigurasjonen er [Kr] 4d8, med uparerte elektroner på en slik måte at den gir en stabilitet.
I motsetning til lineære geometrier rundt Ag ioner+, Det har blitt funnet at det av Agionene3+ Det er firkantet flatt. Derfor et sølvoksyd med Ag ioner3+ ville bestå av lag sammensatt av AgO kvadrater4 (ikke tetraeder) elektrostatisk koblet av AgOAg linjer; Slik er tilfellet av Ag4O4 eller Ag2O ∙ Ag2O3 med monoklinisk struktur.
Fysiske og kjemiske egenskaper

Hvis den overflate av sølvkoppen skrapet hovedbildet, et fast stoff, som ikke bare er svart, men også har brun eller brun (øverst) nyanser oppnås. Noen av dens fysiske og kjemiske egenskaper rapportert av øyeblikkene er følgende:
Molekylvekt
231,735 g / mol
utseende
Solid svart brun i pulverform (merk at det mangler et krystallinsk utseende til tross for at det er et ionisk faststoff). Det er luktfritt og blandet med vann gir det en metallisk smak
tetthet
7,14 g / ml.
Smeltepunkt
277-300 ° C. Sikkert smelter det i solid sølv; det vil si at det sannsynligvis brytes ned før du danner flytende oksid.
KPS
1,52 ∙ 10-8 i vann ved 20 ° C. Det er derfor en sammensatt knapt løselig i vann.
løselighet
Hvis du ser nøye på bildet av dens struktur, finner du at sfærene til Ag2+ og O2- De er ikke uenige nesten i størrelse. Som et resultat kan bare små molekyler trenge gjennom det indre av det krystallinske gitteret, noe som gjør det uoppløselig i nesten alle løsningsmidler; bortsett fra de der den reagerer, for eksempel baser og syrer.
Kovalent karakter
Selv om det har blitt sagt gjentatte ganger at sølvoksyd er en ionisk forbindelse, motsiger visse egenskaper, slik som dens lave smeltepunkt, denne setningen.
Absolutt ikke, vurderingen av den kovalente karakteren bryter ikke ned det som forklares for dets struktur, det ville være nok å legge det til strukturen til Ag2Eller en modell av kuler og barer for å indikere kovalente bindinger.
Også tetraede- og firkantplanene AgO4, så vel som AgOAg-linjene, ville de være forbundet med kovalente (eller kovalente ioniske) bindinger.
Med dette i tankene, Ag2Eller det ville egentlig være en polymer. Imidlertid anbefales det å betrakte det som et ionisk fast stoff med kovalent karakter (hvis arten av koblingen er fortsatt en utfordring i dag).
nedbrytning
I begynnelsen ble det nevnt at dannelsen er termodynamisk reversibel, slik at den absorberer varmen for å gå tilbake til dens metalliske tilstand. Alt dette kan uttrykkes av to kjemiske ligninger for slike reaksjoner:
4Ag (s) + O2(g) => 2Ag2O (s) + Q
2AG2O (s) + Q => 4Ag (s) + O2(G)
Hvor Q representerer varmen i ligningen. Dette forklarer hvorfor brannen som brenner overflaten på den rustne sølvkoppen, returnerer sin silvery glans.
Derfor er det vanskelig å anta at det er Ag2O (l) siden det ville dekomponere umiddelbart ved varme; med mindre trykket er for høyt for å oppnå den brune sorte væsken.
nomenklatur
Når muligheten for Agioner ble introdusert2+ og Ag3+ foruten det vanlige og dominerende Ag+, Begrepet sølvoksyd begynner å virke utilstrekkelig til å referere til Ag2O.
Dette er fordi Agion+ er mer rikelig enn de andre, så Ag er tatt2Eller som det eneste oksydet; som ikke er riktig i det hele tatt.
Hvis du vurderer Ag2+ som praktisk talt ikke-eksisterende, gitt dets ustabilitet, vil bare ioner med valner +1 og +3 være til stede; det vil si, Ag (I) og Ag (III).
Valencias I og III
Å være Ag (I) den minste valensen, heter den ved å legge til suffikset -os til navnet sitt Argentum. Så, Ag2Eller det er: argentosooksid eller, ifølge den systematiske nomenklaturen, diplomatmonoksyd.
Hvis Ag (III) er helt ignorert, må den tradisjonelle nomenklaturen være: sølvoksid istedenfor argentinoksid.
På den annen side, er Ag (III) den større valensen lagt til suffikatet -ico til navnet sitt. Så, Ag2O3 er: sølvoksid (2 Ag ioner)3+ med tre o2-). Dessuten vil navnet i henhold til den systematiske nomenklaturen være: diplatatrioksyd.
Hvis strukturen av Ag observeres2O3, Det kan antas at det er oksidasjonsproduktet av ozon, OR3, i stedet for oksygen. Derfor må kovalent karakter være større, da det er en kovalent forbindelse med Ag-O-O-O-Ag eller Ag-O-bindinger.3-Ag.
Systematisk nomenklatur for komplekse sølvoksyder
AgO, også skrevet som Ag4O4 eller Ag2O ∙ Ag2O3, Det er et sølvoksid (I, III), siden det har både valenser +1 og +3. Navnet etter den systematiske nomenklaturen ville være: tetraplate tetraoxide.
Denne nomenklaturen er til stor hjelp når det gjelder andre støkiometrisk mer komplekse sølvoksyder. For eksempel, anta de to faste stoffene 2Ag2O ∙ Ag2O3 og Ag2O ∙ 3Ag2O3.
Skrive den første på en mer hensiktsmessig måte ville være: Ag6O5 (teller og legger til at atomene av Ag og O). Hans navn vil da være heksaplat-pentoksid. Merk at dette oksydet har en sølvblanding mindre rik enn Ag2O (6: 5 < 2:1).
Mens du skriver det andre faste, ellers ville det være: Ag8O10. Navnet vil være oktaplatatoksid (med et forhold på 8:10 eller 4: 5). Dette hypotetiske sølvoksidet ville være "veldig oksidert".
søknader
Studier på jakt etter nye og sofistikerte bruksområder for sølvoksid utføres fortsatt i dag. Noen av bruksområdene er oppført nedenfor:
-Det oppløses i ammoniakk, ammoniumnitrat og vann for å danne Tollens-reagenset. Dette reagenset er et nyttig verktøy i kvalitative analyser innen organiske kjemi laboratorier. Det gjør det mulig å bestemme tilstedeværelsen av aldehyder i en prøve, idet det positive svaret er dannelsen av et "sølv speil" i reagensrøret.
-Sammen med metallisk sink danner det primære batterier av sinkoksyd av sølv. Dette er kanskje en av de mest vanlige og homelike bruksområder.
-Den tjener som en gassrenser, som absorberer for eksempel CO2. Al calentársele frigir de innestengte gasser, og kan brukes om igjen flere ganger.
-På grunn av de antimikrobielle egenskaper sølv er oksydet nyttig i studier av bioanalyse og jordrensing.
-Det er et mildt oksidasjonsmiddel som er i stand til å oksidere aldehyder til karboksylsyrer. Det brukes også i Hofmann-reaksjonen (tertiære aminer) og deltar i andre organiske reaksjoner, enten som reagens eller katalysator.
referanser
- Bergstresser M. (2018). Sølvoksid: Formel, dekomponering og formasjon. Study. Hentet fra: study.com
- Forfattere og redaktører av volumene III / 17E-17F-41C. (N.d.). Sølv oksyder (Ag (x) O (y)) krystallstruktur, gitterparametre. (Numeriske data og funksjonelle sammenhenger i Science and Technology), vol 41C. Springer, Berlin, Heidelberg.
- Mahendra Kumar Trivedi, Rama Mohan Tallapragada, Alice Branton, Dahryn Trivedi, Gopal Nayak, Omprakash Latiyal, Snehasis Jana. (2015). Potensiell påvirkning av biofelt energibehandling på fysiske og termiske egenskaper av sølvoksidpulver. International Journal of Biomedical Science and Engineering. Vol. 3, nr. 5, s. 62-68. doi: 10.11648 / j.ijbse.20150305.11
- Sullivan R. (2012). Nedbrytning av sølvoksid. University of Oregon Hentet fra: chemdemos.uoregon.edu
- Flint, Deyanda. (24. april 2014). Bruk av sølvoksidbatterier. Sciencing. Hentet fra: sciencing.com
- Salman Montasir E. (2016). Studie av noen optiske egenskaper av sølvoksid (Ag2o) ved bruk av UVVisible spektrofotometer. [PDF]. Hentet fra: iosrjournals.org
- Bard Allen J. (1985). Standard Potensialer i vandig løsning. Marcel Dekker. Hentet fra: books.google.co.ve


