Gulloksyd (III) (Au2O3) struktur, egenskaper, nomenklatur og bruk
den gulloksid (III) er en uorganisk forbindelse hvis kjemiske formel er Au2O3. Teoretisk kan man forvente at naturen skal være av kovalent type. Tilstedeværelsen av en bestemt ionisk karakter i sitt faste stoff kan imidlertid ikke kasseres helt og holdent; eller hva som er det samme, antar fraværet av auksjonen3+ ved siden av anionen O2-.
Det kan virke motstridende at gull, som er et edelt metall, kan ruste. Under normale forhold kan ikke gullstykker (som stjernene i bildet nedenfor) oksyderes ved kontakt med oksygen i atmosfæren; Men når det bestråles med ultrafiolett stråling i nærvær av ozon, OR3, bildet er annerledes.

Hvis gullstjernene ble utsatt for disse forholdene, ville de bli en rødbrun, karakteristisk for Au2O3.
Andre metoder for å oppnå dette oksydet vil innebære kjemisk behandling av stjernene; for eksempel konvertere gullmassen til sitt respektive klorid, AuCl3.
Etter, til AuCl3, og resten av mulige gullsalter dannet, et sterkt basisk medium tilsettes; og med dette får du det hydrerte oksydet eller hydroksidet, Au (OH)3. Til slutt blir denne siste forbindelsen termisk dehydrert for å oppnå Au2O3.
index
- 1 Struktur av gulloksid (III)
- 1.1 Elektroniske aspekter
- 1.2 hydrerer
- 2 Egenskaper
- 2.1 Fysisk utseende
- 2,2 Molekylmasse
- 2.3 tetthet
- 2.4 Smeltepunkt
- 2,5 Stabilitet
- 2.6 Løselighet
- 3 Nomenklatur
- 4 bruksområder
- 4.1 Farging av briller
- 4.2 Syntese av aurater og fulminerende gull
- 4.3 Håndtering av selvmonterte monolag
- 5 referanser
Struktur av gulloksid (III)
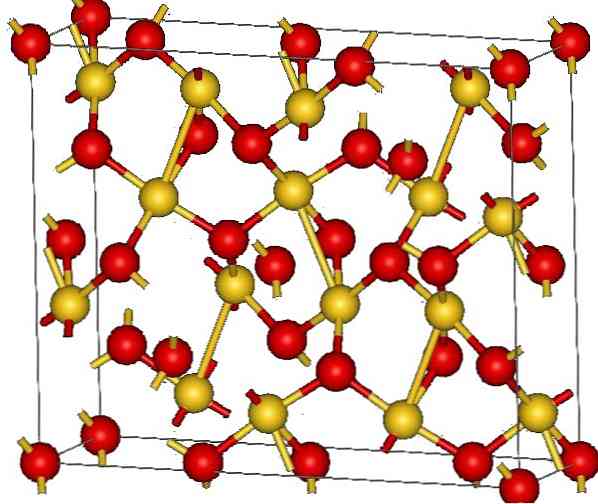
Krystallstrukturen av gull (III) oksyd er vist i det øvre bildet. Arrangementet av gull- og oksygenatomer i faststoffet er vist, enten som nøytrale atomer (kovalent faststoff), eller som ioner (ionisk faststoff). Indisk, det er nok å eliminere eller plassere Au-O-koblingene i alle fall.
Ifølge bildet antas det at den kovalente karakteren dominerer (som ville være logisk). Av den grunn vises atomer og obligasjoner representert med henholdsvis sfærer og stenger. De gyldne kulene samsvarer med gullatomer (AuIII-O), og rødlig til oksygenatomer.
Hvis du ser nøye ut, ser du at det finnes AuO-enheter4, som er forbundet med oksygenatomer. En annen måte å visualisere det ville være å vurdere at hver Au3+ er omgitt av fire O2-; Selvfølgelig, fra et ionisk perspektiv.
Denne strukturen er krystallinsk fordi atomer er bestilt og advarer samme lange rekkevidde mønster. Således svarer dens enhetlige celle til det romboedrale krystallinske systemet (det samme som i det øvre bildet). Derfor er alle Au2O3 kunne bygges dersom alle disse sfærene i enhetscellen ble fordelt i rommet.
Elektroniske aspekter
Gull er et overgangsmetall, og det kan forventes at dets 5d-orbitaler interagerer direkte med oksygenatomens 2p-orbitaler. Denne overlappingen av deres orbitaler skal teoretisk generere ledningsbånd som ville konvertere Au2O3 i en solid halvleder.
Derfor er den sanne strukturen av Au2O3 er enda mer komplekst med dette i tankene.
hydrater
Gulloksyd kan beholde vannmolekyler i sine romboedrale krystaller, noe som gir opphav til hydrater. Når slike hydrater dannes, blir strukturen amorf, det vil si uorden.
Den kjemiske formelen for slike hydrater kan være noe av det følgende, som faktisk ikke er dypt klarlagt: Au2O3∙ zH2O (z = 1, 2, 3, etc.), Au (OH)3, eller AuxOog(OH)z.
Formelen Au (OH)3 representerer en forenkling av den sanne sammensetning av hydrater. Dette skyldes at i gullhydroksidet (III) har forskere også funnet tilstedeværelsen av Au2O3; og derfor er det fornuftig å behandle det isolert som et "enkelt" overgangsmetallhydroksyd.
På den annen side av et fast stoff med formel AuxOog(OH)z en amorf struktur kunne forventes; siden dette avhenger av koeffisientene x, og og z, hvis variasjoner ville gi opphav til alle slags strukturer som nesten ikke kunne utvise et krystallinsk mønster.
egenskaper
Fysisk utseende
Det er et rødbrunt faststoff.
Molekylær masse
441,93 g / mol.
tetthet
11,34 g / ml.
Smeltepunkt
Det smelter og dekomponerer ved 160ºC. Det mangler derfor kokepunkt, slik at dette oksydet aldri når kokepunktet.
stabilitet
Au2O3 det er termodynamisk ustabil fordi, som nevnt i begynnelsen, har ikke gull en tendens til å oksidere under normale temperaturforhold. Så det er lett redusert for å bli igjen det edle gullet.
Jo høyere temperaturen er, jo raskere reaksjonen, som er kjent som termisk nedbrytning. Så, Au2O3 ved 160 ° C nedbrytes det å produsere metallisk gull og frigjøre molekylært oksygen:
2 Au2O3 => 4 Au + 3 O2
En meget lignende reaksjon kan forekomme med andre forbindelser som favoriserer reduksjonen. Hvorfor reduksjon? Fordi gullet returnerer for å få elektronene som oksygen tok vekk fra det; som er det samme som å si at det mister koblinger med oksygen.
løselighet
Det er et fast uoppløselig i vann. Imidlertid er det løselig i saltsyre og salpetersyre, på grunn av dannelsen av gullklorider og nitrater.
nomenklatur
Gull oksid (III) er navnet styrt av lagernomenklatur. Andre måter å nevne er:
-Tradisjonell nomenklatur: aurerisk oksid, fordi valensen 3+ er den høyeste for gull.
-Systematisk nomenklatur: diortrioksyd.
søknader
Farging av briller
En av sine mest fremtredende bruksområder er å gi rødlige farger til visse materialer, for eksempel briller, i tillegg til å gi visse egenskaper som er forbundet med gullatomer..
Syntese av aurates og fulminating gull
Hvis Au er lagt til2O3 til et medium hvor det er oppløselig, og i nærvær av metaller, kan auratene utfelle etter tilsetning av en sterk base; som dannes av AuO anioner4- i selskap med metalliske kationer.
Også Au2O3 reagerer med ammoniakk for å danne den gold fulminerende forbindelsen, Au2O3(NH3)4. Navnet stammer fra det faktum at det er svært eksplosivt.
Håndtering av selvmonterte monolag
På gull og oksyd blir ikke visse forbindelser, slik som dialkyldisulfider, RSSR, adsorbert på samme måte. Når denne adsorpsjon oppstår, dannes en Au-S-binding spontant, hvor svovelatomet utviser og definerer de kjemiske egenskapene til overflaten avhengig av den funksjonelle gruppe som den er bundet til..
RSSR kan ikke adsorbere på Au2O3, men på metallisk gull. Derfor, hvis overflaten av gullet og dets oksidasjonsgrad er modifisert, så vel som størrelsen på partiklene eller lagene av Au2O3, en mer heterogen overflate kan utformes.
Denne overflaten Au2O3-AuSR samhandler med metalliske oksider av visse elektroniske enheter, og dermed utvikler fremtidige smartere overflater.
referanser
- Wikipedia. (2018). Gull (III) oksyd. Hentet fra: en.wikipedia.org
- Kjemisk formulering (2018). Gulloksyd (III). Gjenopprettet fra: formulacionquimica.com
- D. Michaud. (24. oktober 2016). Gulloksider. 911 Metallurgist. Hentet fra: 911metallurgist.com
- Shi, R. Asahi og C. Stampfl. (2007). Egenskaper av gulloksider Au2O3 og Au2O: Førsteprinsipper undersøkelse. Det amerikanske fysiske samfunnet.
- Cook, Kevin M. (2013). Gulloksid som et maskeringslag for regioselektiv overflatekjemi. Avhandlinger og avhandlinger. Papir 1460.


