Acinetobacter baumannii egenskaper, morfologi, metabolisme
Acinetobacter baumannii Det er en gram-negativ bakterie som tilhører rekkefølgen av pseudomonas. Gjennom sin taksonomiske historie har den vært lokalisert i slekten Micrococcus, Moraxella, Alcaligenes, Mirococcuscalco-aceticus, Herellea og Achromobacter, til den lå i sin nåværende sjangre i 1968.
En. baumannii Det er en patogen bakterie, betraktet som arten som oftest er involvert i infeksjoner i slekten sin. Hun har vært involvert i ulike typer infeksjoner som septikemi, lungebetennelse og meningitt..
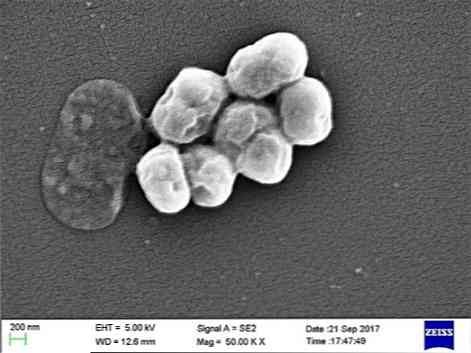
Det er en opportunistisk parasitt som har en viktig forekomst i sykehus- eller nosokomielle sykdommer. Overføring ved mekanisk ventilasjon er blitt indikert som en viktig årsak til infeksjon, spesielt i intensivavdelinger.
Til tross for at det anses som lav grad av patogenet har evnen til å øke dens virulens stammer som er involvert i hyppige infeksjoner. Den har stor kapasitet til å utvikle motstand og multiresistrasjon mot antibiotika.
På sykehus er det overføres først og fremst ved kontakt personale, ved bruk av forurensede sykehus materialer og gjennom luften over korte avstander.
Verdens helseorganisasjon inkluderer A. baumannii I en liste over resistente patogener som det kreves nye antibiotika for, tilordner kategori 1, med kritisk prioritet.
index
- 1 Biologiske egenskaper
- 2 Morfologi
- 3 Metabolisme
- 4 Resistens mot antibiotika
- 5 patologier
- 6 symptomer
- 7 Behandling
- 8 referanser
Biologiske egenskaper
Alle arter av slekten Acinetobacter De har en bred fordeling i forskjellige naturlige nisjer. A. baumannii det kan naturlig bebor huden av friske mennesker, å kunne kolonisere slimete overflater, noe som utgjør et viktig epidemiologisk reservoar. Men habitat av A. baumannii det er nesten eksklusivt for sykehusmiljøer.
Disse bakteriene mangler flagella eller strukturer som brukes til fremdrift. Imidlertid oppnår de bevegelse gjennom strukturer som tillater dem å utvide og trekke seg tilbake, og kjemiske mekanismer som utskillelse av en film av eksopolysakkarid med høy molekylvekt bak bakterien..
A. baumannii kan kolonisere et stort antall levende eller inerte miljøer og har en god evne til å overleve på kunstige overflater over lengre tid.
Denne kapasiteten skyldes muligens evne til å motstå dehydrering, bruk av forskjellige karbonkilder gjennom ulike metabolske veier og muligheten for å danne biofilmer. Av denne grunn er det vanlig å finne det på sykehusutstyr, som katetre og mekaniske ventilasjonsanordninger.
morfologi
A. baumannii er en coccobacillus, mellomliggende i form mellom kokosnøtter og kanner. De måler fra 1,5 til 2,5 med 1 til 1,5 mikron når populasjonene er i en logaritmisk vekstfase. De er mer sfæriske når de kommer til den stasjonære fasen.
metabolisme
Bakterien A. baumannii det er ikke en fermentor av glukose; Det er streng aerob, det vil si, det krever oksygen for stoffskiftet.
Arten av slekten Acinetobacter de er de eneste i familien Moraxellaceae som mangler cytokrom c oksidaser, som de gir negative resultater i oksidasertester.
A. baumannii det vokser ved temperaturer som varierer mellom 20 og 44ºC, den optimale temperaturen er mellom 30 og 35ºC.
Motstand mot antibiotika
Den konstante generasjonen av resistens mot antibiotika hindrer ikke bare behandling og kontroll av infeksjoner produsert av A. baumannii, Det fremmer også valg av endemiske og epidemiske multiresistente stammer.
Noen inneboende mekanismer av A. baumannii, som fremmer antibiotikaresistens:
- Tilstedeværelsen av p-laktamaser gir resistens mot b-laktamer.
- Fremstillingen av spesifikke enzymer som amoniglucósido 3'-fosfotransferase VI inaktiverer amikacin.
- Tilstedeværelsen av oksacillinas OXA-51 hydrolyserer penicilliner og karbapenemer.
- Tilstedeværelsen og over-ekspresjon av medikament efflukspumpene, som er pumper som driver ut utenfor cellen til små molekyler som er i stand til å gå inn i cytoplasma, redusere dens følsomhet for antibiotika.
Biofilmene genereres av A. baumannii de endrer metabolismen av mikroorganismer, reduserer deres følsomhet overfor antibiotika, i tillegg til å gi en fysisk barriere mot store molekyler og forhindre dehydrering av bakterier.
patologi
A. baumannii koloniserer en ny vert ved kontakt med infiserte personer, eller med forurenset medisinsk utstyr. Først adheres denne bakterien til hud og slimhinner. For å reprodusere, må den overleve antibiotika og hemmende midler og forholdene til disse overflatene.
Økningen i antallet bakterier på slimhinneoverflater, særlig i innleggelse kontakt intravaskulære katetere eller endotrakeal-rør, kan øke risikoen for infeksjon av luftveiene og blodet.
Lungebetennelse kontraheres på sykehus er den mest vanlige av infeksjonene produsert av A. baumanii. Vanligvis inngått i Intensive Care Units, av pasienter som får mekanisk assistert pust.
A. baumanii Det har også forårsaket store problemer på grunn av infeksjoner i militært personell med etterkrigstrauma, spesielt i Irak og Afghanistan. Spesielt på grunn av osteomyelitt og myke vevsinfeksjoner, som kan forårsake nekrose og cellulitt.
Det er også risiko for meningitt fra A. baumanii hos pasienter som gjenoppretter fra nevrokirurgi.
Personer utsatt for infeksjon av A. baumanii inkluderer de som tidligere er blitt utsatt for antibiotika, større kirurgiske inngrep, brannskader, traume immunsuppresjon eller bruk av invasive medisinsk utstyr, primært for mekanisk ventilasjon på intensivavdelinger.
symptomer
Det er ingen spesifikk symptomatologi av infeksjoner på grunn av A. baumanii. Hver av de forskjellige infeksjonene som produseres av denne bakterien har sine egne karakteristiske symptomer.
Generelt symptomene på infeksjoner som kan innebære A. baumanii eller andre opportunistiske bakterier som Klebsiella pneumoniae og Streptococcus pneumoniae, De kan være feber, frysninger, utslett, smertefull vannlating, presserende behov for å urinere ofte, forvirring eller endret mentale tilstander, kvalme, muskelsmerter, brystet og hoste.
behandling
Antibiotika til å behandle infeksjoner A. baumannii De er ekstremt begrensede på grunn av sin store evne til å skaffe seg motstand og multiresistance. Derfor er det viktig å bestemme susceptibiliteten til hver stamme til forskjellige antibiotika for å sikre effektiviteten av hver behandling.
I lys av motstanden mot karbapenem er bruk av polymyxiner, spesielt kolistin, blitt brukt, til tross for at de har en relativt lav motstandsindeks og dets bivirkninger på nyrene..
Imidlertid er det allerede oppdaget stammer som er resistente mot kolistin. Som et alternativ til resistens mot disse antibiotika, har kombinasjonsbehandling vært brukt.
referanser
- Bergogne-Bérézin, E. & Towner, K.J. Acinetobacter spp. som nosokomielle patogener: mikrobiologiske, kliniske og epidemiologiske egenskaper. Clin Microbiol Rev, 9 (1996), s. 148-165.
- Fournier, P.E., Richet, H. (2006). Epidemiologien og kontrollen av Acinetobacter baumanii i helsesektoren. Kliniske smittsomme sykdommer, 42: 692-9.
- Hernandez Torres, A., Garcia Vázquez, E., Yague, G. & Gomez Gomez, J. (2010) Acinetobacter baumanii multiresistant: nåværende klinisk situasjon og nye perspektiver Spansk Journal of Chemotherapy, 23 (1): 12-19.
- Maragakis LL, Perl TM. Acinetobacter baumanii: Epidemiologi, Antimikrobiell Resistance og Behandlingsalternativer. Clin Infec Dis 2008; 46: 1254-63.
- McConnell, M.J., Actis, L. & Pachón, J. (2013) Acinetobacter baumannii: menneskelige infeksjoner, faktorer som bidrar til patogenese og dyremodeller. FEMS Microbiology Reviews, 37: 130-155.
- Peleg, A.Y., Seifert, H. & Paterson, D.L. (2008). Acinetobacter baumannii: fremveksten av et vellykket patogen. Klinisk mikrobiologi vurderinger, 21 (3): 538-82.
- Vanegas-Múnera, J.M., Roncancio-Villamil, G. & Jiménez-Quiceno, J.N. (2014). Acinetobacter baumannii: klinisk betydning, motstandsmekanismer og diagnose. CES Medicine Journal, 28 (2): 233-246.


