Spore-fargestifter, teknikker og bruksområder
den spore farging er metoden brukt til å farge motstandsstrukturer som danner noen bakteriegenera når de er i ugunstige forhold; Disse strukturene samsvarer med en måte å overleve.
Det er mange slanger som danner sporer; De viktigste er imidlertid Bacillus og Clostridium. Disse slaktene anses å være mer relevante fordi de har patogene arter for mennesker.
Hver bacillus kan gi opphav til en spore. På tidspunktet for farging av preparatet, kan sporet bli funnet inne i bacillus (endospore) eller utenfor det (exospore). Med konvensjonelle fargingsteknikker for bakterier - som Gram-flekk - forblir sporer fargeløs.
For tiden er det flere fargemetoder som er i stand til å krysse sporets tykke struktur for å fargestille den. Disse metodene er svært varierte; blant disse kan vi nevne Dorner-teknikken, Möeller-flekken og Shaeffer-Fulton-metoden, også kjent som Wirtz-Conklin..
Av alle nevnte teknikker er Shaeffer-Fulton-metoden den mest brukte i rutinemessige laboratorier. Den skylder sitt navn til to mikrobiologer som skapt fargeleggingen i 1930: Alicia Shaeffer og MacDonald Fulton. Men noen ganger kalles teknikken Wirtz-Conklin til ære for to bakteriologer fra 1900-tallet.
index
- 1 Foundation
- 2 Spore fargingsteknikker
- 2.1 Dorners teknikk
- 2.2 Modifisert Dorner-teknikk
- 2.3 Teknikk av Shaeffer-Fulton eller Wirtz-Conklin
- 2.4 Möeller teknikk
- 2.5 Modifisert Möeller teknikk uten varme
- 3 bruksområder
- 3.1 Eksempler
- 4 referanser
fundament
Sporene flekker ikke med konvensjonelle fargestoffer fordi de har en veldig tykk vegg. Spores komplekse sammensetning forhindrer innføring av de fleste fargestoffer.
Hvis spore utenfor i å studere følgende lag er observert: for det første er det exosporium, som er det ytre sjikt er dannet av glykoproteiner.
Deretter kommer kutikula, som gir motstand mot høye temperaturer, etterfulgt av cortex sammensatt av peptidoglykan. Deretter er det veggen til basen som beskytter protoplastet.
Sporet er en dehydrert struktur som inneholder 15% kalsium og dipikolinsyre. Derfor er de fleste sporefargingsteknikker basert på påføring av varme slik at fargestoffet kan trenge inn i den tykke strukturen.
Når sporet er farget, kan det ikke eliminere fargestoffet. I den teknikk som Shaeffer-Fulton malakittgrønt trer vegetative celler og, ved anvendelse av varme, penetrerer endospore og også i exosporas.
Når det vaskes med vann fjernes fargestoffet fra den vegetative cellen. Dette skjer fordi den grønne malakittfargen er litt grunnleggende, så den binder svakt til den vegetative cellen.
På den annen side kan den ikke komme ut av sporet og til slutt er bacillus med safranin kontrastert. Dette grunnlaget er gyldig for resten av teknikkene, der noe lignende skjer.
Spore fargingsteknikker
For å få sporer flekker, må du ha en ren kultur av den mistenkte belastningen du vil studere.
Kulturen blir utsatt for ekstreme temperaturer i 24 timer for å stimulere mikroorganismen til å sporulere. For dette kan kulturen plasseres i en ovn ved 44 ° C eller i kjøleskap (8 ° C) i 24 eller 48 timer.
Hvis for mye tid er igjen ved de nevnte temperaturene, vil kun eksosporer bli observert, siden alle endosporene vil ha forlatt bacillus.
På slutten av tiden bør et par dråper steril fysiologisk oppløsning plasseres på et rent lysbilde. Deretter tas en liten del av avlingen og en fin spredning gjøres.
Etterpå er det igjen å tørke, det er festet til varmen, og det er farget med noen av teknikkene som er forklart nedenfor:
Dorners teknikk
1- Fremstille i en testrør en konsentrert suspensjon av sporulert mikroorganisme i destillert vann og tilsett et like stort volum filtrert Kinyoun fenol fuchsin.
2- Legg røret i et bad med kokende vann i 5 til 10 minutter.
3- På et rent lysbilde blandes en dråpe med den forrige suspensjonen med en dråpe 10% nigrosin vandig løsning, kokt og filtrert.
4- Forleng og tørk raskt med mild varme.
5- Undersøk med 100X objektiv (nedsenking).
Sporene flekker rødt og bakteriecellene vises nesten fargeløse mot en mørk grå bakgrunn.
Modifisert Dorner-teknikk
1- En suspensjon av sporulert mikroorganisme er spredt på et lysbilde og festet til varmen.
2- Prøven er dekket med en strikke av filterpapir, til hvilken det legges fettsyrefuksin. Fargestoffet oppvarmes i 5 til 7 minutter med Bunsen-brennerens flamme inntil utslipp av damp er generert. Deretter fjernes papiret.
3- Vask preparatet med vann og tørk deretter med absorberende papir.
4- Dekke smeten med en tynn film med 10% nigrosin, bruk et andre lysbilde for å spre nigrosin eller en nål.
Fargen som tas av sporer og bakterier er den samme som den som er beskrevet i den kjente teknikk.
Shaeffer-Fulton eller Wirtz-Conklin teknikk
1- Lag et tynt spred med en suspensjon av sporulert mikroorganisme på et lysbilde og fest det til varme.
2- Dekk lysbildet med en vandig løsning av 5% malakittgrønn (et filterpapir kan plasseres på arket).
3- Varme på Bunsenbrennerens flamme for å få damp å rømme og ta av flammen. Gjenta operasjonen i 6 til 10 minutter. Hvis den malakittgrønne løsningen fordampes for mye under prosessen, kan flere tilsettes.
4- Fjern filterpapiret (hvis det ble plassert) og vask med vann.
5- Dekk av glassplatene med 0,5% vandig safranin i 30 sekunder (noen varianter av teknikken ved anvendelse av 0,1% vandig safranin og la stå i 3 minutter).
Med denne teknikken er sporene grønne og bacillene er røde.
Det har ulempen at endosporene av unge kulturer ikke flekker godt, siden de ser ekstremt klart eller farveløst ut. For å unngå dette anbefales det å bruke kulturer med 48 timers inkubasjon.
Möeller teknikk
1- Dekk smøret med kloroform i 2 minutter.
2- Kast kloroformen ut.
3- Dekk med 5% kromsyre i 5 minutter.
4- Vask med destillert vann
5- Platen er dekket med fuchsin-fenolisk karpe og eksponert for flammen til Bunsen-brenneren til utslipp av dampe; så blir den fjernet fra flammen i noen få øyeblikk. Operasjonen gjentas til den når 10 minutter.
6- Vask med vann.
7- Bruk surgjort etanol (saltsyre) til avfarging. Den er igjen i 20 eller 30 sekunder.
8- Vask med destillert vann.
9-Motvirke dekker arket med metylenblått i 5 minutter.
10- Vask med destillert vann.
11- Det blir igjen å tørke og prøven er tatt under et mikroskop.
Sporer ser rød og blå baciller. Det er viktig å ikke inhalere damper, fordi de er toksiske og på lang sikt kan de være kreftfremkallende.
Modifisert Möeller teknikk uten varme
I 2007 skapte Hayama og hans medarbeidere en modifisering av Möeller-teknikken. De elimineres trinnet med oppvarming av fargestoff og erstattet ved tilsetning av 2 dråper overflateaktivt Tergitol 7 per 10 ml oppløsning karbol fuksin-karbol. De samme resultatene ble oppnådd.
søknader
Farging sporer gir et meget verdifullt og nyttig for patogen identifikasjonsinformasjon, da nærværet av det samme, form, plassering inne i bacillus og evnen til å deformere den vegetative celle eller ikke, er data som kan lede på arten involvert i et bestemt kjønn.
I denne sammenheng er det verdt å nevne at sporene kan være runde eller ovale, de kan være plassert i sentrum eller også i paracentral, subterminal eller terminal stilling.
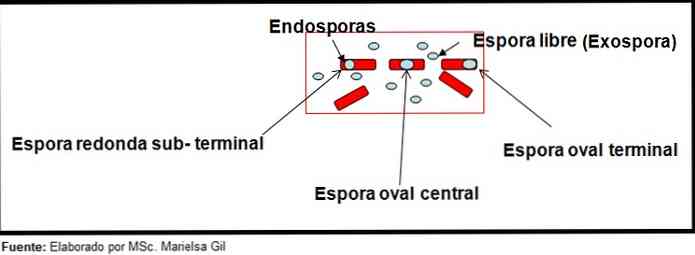
eksempler
- Clostridium difficile danner en oval spor i terminal posisjon som deformerer bacillus.
- Sporet av Clostridium Tertium Den er oval, deformerer ikke bacillus og ligger på terminalnivå.
- Endosporene av Clostridium tetani det er terminal og deformerer bacillus, noe som gir utseendet til en trommelstick.
- Sporene av Clostridium botulinum, C. histolyticum, C. Novy og C. septicum de er runde eller subterminale ovale og deformere bacillus.
- Endosporene av Clostridium sordelli Den ligger i den sentrale posisjonen, med en liten deformasjon.

referanser
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Forslag av en forenklet teknikk for farging av bakteriesporer uten Tilførsel av varme-vellykket modifikasjon av Moeller metode. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Wikipedia bidragsytere. Moeller flekker. Wikipedia, The Free Encyclopedia. 3. november 2018, 03:28 UTC. Tilgjengelig på: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Laboratory Manual of Microbiological Techniques. Institutt for grunnvitenskap Akademi for mikrobiologi. National Polytechnic Institute.
- "Endospore." Wikipedia, Den frie encyklopedi. 25. februar 2018, 10:20 UTC. 10. januar 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernandez N, God C, Torres J, M Rico, J Macias et al. (2006). Arbeidspersonell i det autonome samfunnet i Extremadura. Spesifikk dagsorden Volum IV. Redaksjonell MAD. Sevilla-Spania, s. 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006). Spesialist laboratorie tekniker, av den galiciske helsetjenesten (SERGAS). Emne spesifikk volum 2. Redaksjonell MAD. Sevilla-Spania, s. 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. (5. utgave). Argentina, Editorial Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Mikrobiologisk diagnose av Bailey & Scott. 12 ed. Argentina. Panamericana S.A Editorial


