Giemsa-fargestift, materialer, teknikk og bruk
den Giemsa flekk er en type farging av kliniske prøver, basert på blandingen av syre og basiske fargestoffer. Skapelsen ble inspirert av det arbeidet som Romanowsky gjorde, hvor Gustav Giemsa, kjemiker og bakteriolog fra Tyskland, perfeksjonerte det ved å legge til glyserol for å stabilisere forbindelsene.
Endringene som ble generert til den opprinnelige teknikken til Romanowsky, fikk lov til å forbedre de mikroskopiske observasjonene betydelig, derfor ble teknikken døpt med navnet Giemsa stain.
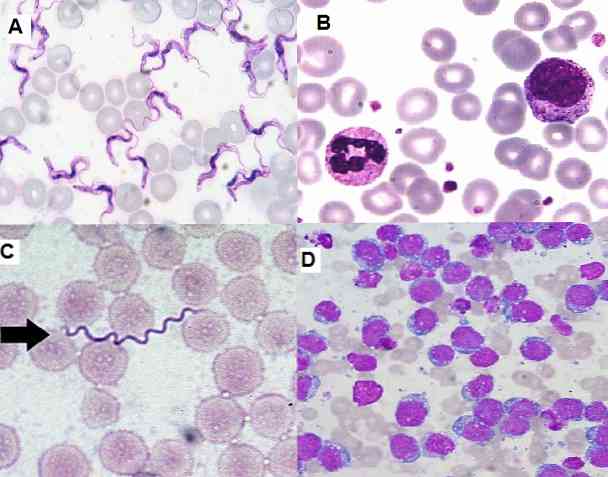
Fordi det er en enkel teknikk å utføre, svært funksjonell og økonomisk, er den for tiden mye brukt i det kliniske laboratoriet for hematologiske utstrykninger, benmargsprøver og vevseksjoner..
Giemsa-fargingsteknikken er meget nyttig for cytologiske studier, siden det tillater observasjon av spesifikke strukturer av celler. Denne teknikken flekker cytoplasmaene, kjernene, nukleolene, vakuolene og granulene av cellene, og er i stand til å skille selv fine spor av kromatin.
I tillegg kan signifikante endringer i størrelsen, formen eller fargekilden av kjernen detekteres, der det er mulig å visualisere tapet av kjernekytoplasmaforholdet.
På den annen side tillater det å identifisere umodne celler i beinmarg og perifert blod, som er viktige for diagnostisering av alvorlige sykdommer som leukemi. Det er også mulig å oppdage hemoparasitter, ekstra og intracellulære bakterier, sopp, blant andre.
I cytogenetikk er det ganske brukt, siden det er mulig å studere mitosen av celler.
index
- 1 Stiftelsen av Giemsa-fargen
- 2 materialer
- 2.1 Materialer til fremstilling av morsløsningen
- 2.2 Forberedelsesmodus av moderløsningen
- 2.3 Materialer for å forberede bufferløsningen
- 2.4 Endelig preparering av fargestoffet
- 2.5 Ytterligere materialer som trengs for å utføre fargen
- 3 Teknikk
- 3.1 Fargeprosess
- 4 Verktøy
- 4.1 Hematologi
- 4.2 Mykologi
- 4.3 Bakteriologi
- 4.4 Parasitologi
- 4,5 cytologi
- 4.6 Cytogenetikk
- 5 Forskning som demonstrerer effektiviteten av Giemsa-farging
- 6 Anbefalinger for god farging
- 7 Vanlige feil i fargen på Giemsa
- 7.1 Ekstremt blå farge
- 7.2 Overdimensjonert rosa fargestoffer
- 7.3 Tilstedeværelse av nedbør i smeten
- 7.4 Tilstedeværelse av morfologiske artefakter
- 8 Lagringsmodus
- 9 referanser
Stiftelsen av Giemsa-fargen
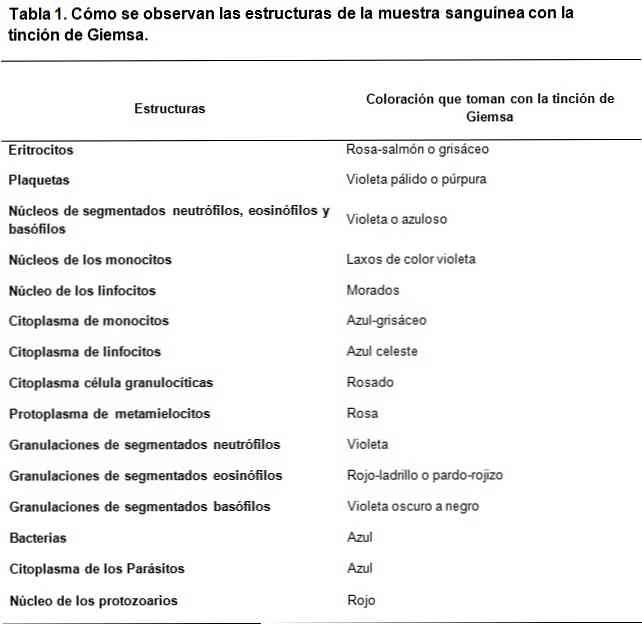
Romanowsky-type fargestoffer er basert på bruk av en kontrast mellom syre og basiske fargestoffer, for å oppnå farging av henholdsvis basis- og syrekonstruksjonene. Som det kan ses er det en affinitet av syrefarger å fargestille de grunnleggende strukturer og omvendt.
Det grunnleggende fargestoffet som benyttes er metylenblått og dets oksyderte derivater (Azure A og Azure B), mens syrefargen er eosin.
Syrestrukturene til cellene er nukleinsyrene, granulene av de segmenterte basofilene, blant annet, derfor blir de farget med metylenblå.
På samme måte er de grunnleggende strukturer av cellene hemoglobin og noen granuler som de som finnes i segmenterte eosinofiler, blant andre; Disse vil bli farget med eosin.
Dessuten, fordi den metylenblått og asur er karakterisert ved metakromatisk fargestoffer, kan de gi en variabel fargetone forskjellige strukturer i henhold til belastningen av polyanioner som har.
Således er strategisk kombinasjon av sure og basiske fargestoffer er i stand til å utvikle et bredt spekter av farger, i samsvar med de biokjemiske egenskapene til hver struktur, pacing blekblå mørkeblå farve, lilla lilla og i tilfelle av de sure strukturer.
Mens fargen som eosin gir, er mer stabil, genererer farger mellom rød-oransje og laks.
materialer
Materialer til fremstilling av morsløsningen
Utarbeidelsen av stamløsningen krever veiing av 600 mg pulverisert Giemsa-fargestoff, som måler 500 ml acetonfri metylalkohol og 50 cm nøytral glyserin.
Forberedelsesmodus av moderløsningen
Legg det tunge Giemsa-pulveret i en mørtel. Hvis det er klumper, skal de sprøytes. Deretter legger du til en merkbar mengde målt glycerin og blander godt. Den oppnådde blanding helles i en meget ren, gul flaske.
Resten av glycerin er plassert i mørtel. Bland igjen for å rense gjenværende fargestoff som har sittet fast på murene og hell i samme flaske.
Flasken er dekket og båret i 2 timer i et vannbad ved 55ºC. Mens du er i et bain-marie-bad, rør lett blandingen hver halve time eller så.
Deretter får blandingen avkjøles for å plassere alkoholen. Tidligere er en del av målt alkohol plassert i mørtel for å fullføre vaskingen av det som er igjen av fargestoffet og deretter tilsettes blandingen sammen med resten av alkoholen.
Dette preparatet bør ha lov til å modnes i minst 2 uker. Delen som brukes av morsløsningen må filtreres.
For å unngå forurensing av preparatet anbefales det å passere den delen som vil være i konstant bruk til en liten, rav flaske med dråper. Lad opp hver gang reagenset løper ut.
Materialer som skal tilberedes for bufferløsningen
På den annen side fremstilles en bufferløsning ved pH 7,2 som følger:
6,77 gram natriumfosfat (vannfri) veies (NaHPO4), 2,59 g kaliumdihydrogenfosfat (KH)2PO4) og destillert vann opp til 1000 cc.
Endelig preparering av fargestoffet
Til fremstilling av den endelige fargeløsningen måles 2 cc av den filtrerte stamopløsningen og blandes med 6 cc av bufferoppløsningen. Blandingen omrøres.
Et relevant faktum som må tas i betraktning er at teknikkene for fremstilling av fargestoffet kan forandres i henhold til det kommersielle huset.
Ytterligere materialer som trengs for å utføre fargen
Bortsett fra de beskrevne materialer, skal det være utstyrt med fargebroer, vannskjermer eller buffer for vasking, ark for gjenstander eller dekker, en stoppeklokke for å kontrollere fargetider og blottingpapir eller noe materiale som kan brukes til å tørke ( gasbind eller bomull).
teknikk
Fargeprosess
1) Før du farger, må du ha prøvespredningen på et rent lysbilde..
Prøver kan være blod, benmarg, kutt av histologiske vev eller cervico-vaginale prøver. Det anbefales at yttersiden er tynn og har 1 eller 2 timer tørking før du farger dem.
2) Alle arkene du må farge er plassert på en farget bro. Arbeid alltid i samme rekkefølge og identifiser hvert ark godt.
3) Legg noen dråper 100% metylalkohol (metanol) på smøret og la det stå i 3 til 5 minutter for å fikse og dehydrere prøven.
4) Kast metanolen i arket og la det lufttørke.
5) Når det er tørt, plasser den endelige fargeløsningen med en dråpe til hele arket er dekket. La på i 15 minutter. Noen forfattere anbefaler opptil 25 min. Avhenger av det kommersielle huset.
6) Tørk fargestoffet og vask smeten med destillert vann eller med 7,2 bufferløsning.
7) På et blottpapir la arkene tørke utendørs, arrangert vertikalt ved hjelp av en støtte.
8) Tørk baksiden av lysbildet med en gasbind eller bomullspinne fuktet med alkohol for å fjerne resterende farger.
verktøy
Giemsa-fargeteknikken brukes på flere områder, inkludert: hematologi, mykologi, bakteriologi, parasitologi, cytologi og cytogenetikk.
hematologi
Det er det hyppigste verktøyet som er gitt til denne fargingen. Med det kan vi identifisere hver og en av cellene tilstede i prøver av benmarg eller perifert blod. I tillegg til å estimere antallet av hver serie, er det mulig å oppdage leukocytose eller leukopeni, trombocytopeni etc..
Fordi det er følsomt for å identifisere umodne celler, er det relevant ved diagnosen akutte eller kroniske leukemier. Det er også mulig å diagnostisere anemi, blant annet seglcelle sykdom, seglcelle sykdom, blant andre..
mykologi
I dette området er det vanlig å bruke den til å søke etter Histoplasma kapulatum (intracellulær dimorf svamp) i vevsprøver.
bakteriologi
I hematologiske utstrykninger farget med Giemsa er det mulig å oppdage Borrelias sp hos pasienter som har sykdommen kalt feberrekurrens. Spiroketene er rikelig blant erytrocyter, i prøver tatt ved febrile toppen.
Det er også mulig å visualisere intracellulære bakterier som Rickettsias sp og Chlamydia trachomatis i infiserte celler.
parasittologi
På området parasitologi har Giemsa-farging tillagt diagnostisering av parasittiske sykdommer som malaria, Chagas sykdom og leishmaniasis..
I de to første parasittene Plasmodium sp og Trypanosoma cruzi henholdsvis de kan visualiseres i perifert blod av de infiserte pasientene, de kan bli funnet i forskjellige stadier i henhold til den fase i hvilken sykdommen er.
For å forbedre søket etter blodsparasitter anbefales det å bruke Giemsa flekk blandet med May-Grünwald-fargestoffet.
På samme måte kan kutan leishmaniasis bli diagnostisert ved evaluering av prøver av hudbiopsier farget med Giemsa, hvor parasitten er funnet.
cytologi
Giemsa-farging brukes også til den cytologiske studien av endocervikale prøver, selv om det ikke er den mest brukte teknikken for dette formålet.
Men i tilfeller av mangel på ressurser kan brukes, med en funksjonalitet som ligner den som tilbys av Papanicolaou teknikken og til en lavere pris. Det krever imidlertid ekspertise fra eksaminatorens side.
cytogenetikk
En relevant egenskap ved Giemsa-farging er dens evne til å binde sterkt til regioner som er rike på DNA-adeniner og tyminer. Dette gjør at DNA kan visualiseres under mitos av cellene, i forskjellige kondensasjonsbetingelser.
Disse studiene er nødvendige for å oppdage kromatiske avvik som for eksempel duplikasjoner, deletjoner eller translokasjoner av de forskjellige områdene av kromosomene..
Forskning som demonstrerer effekten av Giemsa-farging
Cannova et al (2016), sammenlignet 3 fargeteknikker for diagnostisering av kutan leishmaniasis.
For dette brukte de prøver hentet fra et eksperimentelt dyr (Mesocrisetus auratus) eksperimentelt inokulert med Leishmanias.
Forfatterne viste at Giemsa-farging var bedre enn Pap-mart® og Gaffney-farging. Derfor vurderte de at Giemsa flekken er ideell til å diagnostisere kutan leishmaniasis.
De utmerkede resultater som er oppnådd av forfatterne er på grunn av kombinasjonen av fargestoffer som utgjør blandingen av Giemsa presenterer de betingelser som er nødvendige for å skape en god kontrast, slik at klart skille strukturer amastigotes både intra og ekstracellulært.
De andre teknikkene (Pap-mart® og Gaffney) gjorde det også, men på en svakere måte og derfor vanskeligere å visualisere. Det er derfor Giemsa-flekken anbefales for den parasitologiske diagnosen leishmaniasis.
På samme måte, en studie av Ramírez et al (1994), evaluerte gyldigheten av Giemsa og Lendrum flekker i conjunctival smears for identifisering av Chlamydia trachomatis.
Forfatterne fastslått at Giemsa og Ledrum-farging har samme spesifisitet, men Giemsa var mer følsom.
Dette forklarer hvorfor Giemsa-farging er den hyppigst brukt for diagnostisering av chlamydialinfeksjoner, spesielt hvis det er få ressurser.
Anbefalinger for god farging
Tørking av arkene bør ikke akselereres. Forsiktigstiden må ventes for å tørke den i friluft. Ca 2 timer.
Farge umiddelbart etter 2 timer for best resultat.
For at smørene skal festes og flekker bedre, må prøven fordeles på arket på en slik måte at et tynt og jevnt lag gjenstår.
Den foretrukne blodprøven er kapillæren, siden smeten er laget direkte fra bloddråpet, og derfor har prøven ingen tilsetningsstoffer som favoriserer vedlikeholdet av cellestrukturer.
Men hvis venøst blod brukes, skal EDTA brukes som antikoagulant og ikke heparin, siden sistnevnte deformerer vanligvis cellene.
Vanlige feil i fargen på Giemsa
I praksis med denne fargingen kan feil gjøres. De er påvist ved plutselige endringer i nyanser av strukturer.
Ekstremt blå farge
Det kan skyldes:
- Veldig tykke smører
- Overskrider fargetiden
- For lite vask.
- Bruk av reagenser godt over nøytral pH (alkalisk).
Under disse forholdene fargene på følgende strukturer er forvrengt, slik at erytrocytter snarere enn farget rosa laks vil være grønn, vil granulater av eosinofile som bør farget rød murstein blålig eller grå snu og så videre vilje avvik i de vanlige tonaliteter.
Overdreven rosa farge
Det kan skyldes:
- Utilstrekkelig fargetid.
- Langvarig eller overdreven vasking.
- Dårlig tørking.
- Bruk av svært sure reagenser.
I dette spesielle tilfellet vil strukturer som normalt er farget blå ikke være nesten synlige, mens strukturer som er farget rosa vil ha svært overdrevne tonaliteter.
Eksempel: erytrocytene vil ta en lys rød eller sterk oransje farge, kjernefysisk kromatin vil se blekrosa og granulene av eosinofilene vil bli rødt..
Tilstedeværelse av nedbør i smeten
Årsakene kan være:
- Bruk skitne eller dårlig vasket ark.
- Ikke la smøret tørke godt.
- La løsningsløsningen være for lang.
- Utilstrekkelig vask på slutten av flekker.
- Utilstrekkelig filtrering eller ikke-filtrering av fargen som brukes.
Tilstedeværelse av morfologiske artefakter
Morfologiske artefakter kan vises i smørene, noe som gjør det vanskelig å visualisere og tolke strukturer som er til stede. Dette skyldes:
- Type antikoagulant som brukes, for eksempel heparin.
- Bruk av skitne, skadede eller fettete ark.
Lagringsmodus
Etter preparatet bør fargen holdes ved romtemperatur (15-25 ° C) for å forhindre at fargestoffet faller ut. Det må oppbevares i en lukket gultbeholder.
referanser
- Cannova D, Brito E og Simons M. Evaluering av fargeteknikker for diagnostisering av kutan leishmaniasis. Salus. 2016; 20 (2): 24-29.
- PanReac Applichem ITW Reagents. Giemsa flekk. Versjon 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Spania.
- Clark G. Staining-prosedyrer (1981), fjerde. Williams & Willkins.
- Anvendt klinisk kjemi Giemsa fargestoff for diagnose in vitro. Distributør: cromakit.es
- Ramirez R, Mejia M, Garcia de la Riva J, F og Hermes Grazioso C. gyldighet Giemsa og Lendrum i konjunktivale vattpinner for å identifisere Chlamydia trachomatis. Bol av Sanit Panam. 1994; 116 (3): 212-216.
- Casas-Rincon G. Generell mykologi. 1994. 2. utg. Universidad Central de Venezuela, Bibliotek utgaver. Venezuela, Caracas.
- "Giemsa flekk." Wikipedia, Den frie encyklopedi. 1. september 2017, 01:02 UTC. 6 desember 2018, en.wikipedia.org.


