Ziehl-Neelsen Stain Foundation, reagenser og teknikk
den Ziehl-Neelsen flekken i en fargeteknikk for å identifisere alkoholresistente mikroorganismer (AAR). Navnet på denne mikrobiologiprosedyren refererer til dets forfattere: bakteriologen Franz Ziehl og patologen Friedrich Neelsen.
Denne teknikken er en form for differensialfargestoffer, som innebærer bruk av forskjellige farger for å skape kontrast mellom strukturer som ønsker å observere, identifisere og deretter skille. Ziehl-Neelsen flekken brukes til å identifisere bestemte typer mikroorganismer.
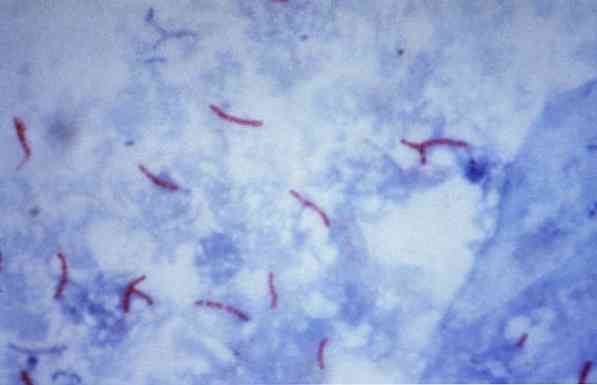
Noen av disse mikroorganismer er mykobakterier (for eksempel, Mycobacterium tuberculosis), nocardier (for eksempel, Nocardia sp.) og noen unicellulære parasitter (for eksempel, Cryptosporidium parvum). Mange av bakteriene kan klassifiseres ved en vanlig teknikk som kalles Gram stain.
Noen bakteriegrupper krever imidlertid andre metoder for å identifisere dem. Teknikker som Ziehl-Neelsen-farging krever kombinasjoner av fargestoffer med varme for å fikse den første til celleveggen.
Deretter kommer en misfargingsprosess som gir to resultater: motstand eller følsomhet for misfarging av syrer og alkoholer.
index
- 1 Foundation
- 1.1 Sekundær farging
- 2 Reagenser
- 2.1 Primærfarging
- 2.2 Dekoloriserende løsning
- 2.3 Sekundær farging (anti-fargestoff)
- 3 Teknikk
- 3.1 Acid-rask fargingsprosedyre
- 4 referanser
fundament
Grunnlaget for denne fargingsteknikken er basert på disse egenskapene til disse mikroorganismer. Veggen er dannet av en type fettsyrer som kalles mykolsyre; Disse er preget av svært lange kjeder.
Når fettsyrer har svært lange strukturer, kan de holde fargestoffer lettere. Noen arter av bakterier er svært vanskelig å plette av Gram-flekker, på grunn av den høye mykolsyreinnholdet i celleveggen.
I Ziehl-Neelsen-flekken brukes fenolforbindelsen carbol fuchsin, et grunnfarve. Dette har evnen til å interagere med fettsyrene i celleveggen, som er voksaktig tekstur ved romtemperatur.
Carbol fuchsin-farging forbedres i nærvær av varme, fordi voksmeltene og fargemolekylene beveger seg raskere inn i cellevegget.
Syren som brukes senere, tjener til å misfargere cellene som ikke ble farget fordi deres vegg ikke var tilstrekkelig relatert til fargestoffet; Derfor er styrken av syrekolorisatoren i stand til å fjerne syrefargen. Cellene som motstår denne misfargingen kalles syrefast.
Sekundær farging
Etter misfarging av prøven er dette kontrastert med et annet fargestoff som kalles sekundær fargestoff. Methylenblå eller malakittgrønn er vanligvis brukt.
Det sekundære fargestoffet flekker bakgrunnsmaterialet og skaper følgelig kontrast til strukturer som ble farget i første trinn. Bare de misfargede cellene absorberer det andre fargestoffet (anti-flekken) og tar farge, mens de syrefaste cellene beholder den røde farge.
Denne prosedyren brukes ofte til identifisering av Mycobacterium tuberculosis og Mycobacterium leprae, som kalles syrefaste baciller.
reagenser
Primærfarging
Carboxin 0,3% fuchsin (filtrert) brukes. Dette fargestoff ble fremstilt fra en blanding av alkoholer: fenol i etanol (90%) eller metanol (95%), og denne blandingen ble det oppløst 3 g basisk fuksin.
Dekoloriserende løsning
I dette trinnet kan du bruke løsninger på 3% alkoholsyre eller 25% svovelsyre.
Sekundær farging (anti-fargestoff)
Fargestoffet som oftest brukes til å utføre kontrasten i prøvene, er vanligvis 0,3% metylenblå. Imidlertid kan andre også brukes, for eksempel 0,5% malakittgrønn.
teknikk
Syr-rask fargingsprosedyre
Forbered en bakteriell smøring
Dette preparatet er laget på et rent og tørt lys, etter sterilitetsforanstaltninger.
Tørker smøret
La smøret tørke ved romtemperatur.
Varm prøven
Prøven må oppvarmes ved å bruke brann til lysbildet under. Det kan gjøre en fiksering med alkohol når smøre ikke er utarbeidet med sputum (behandlet med natriumhypokloritt for å bleke) og hvis ikke en gang være farget.
M. tuberculosis Det elimineres med blekemiddel og under fargeprosessen. Termofixering av ubehandlet sputum vil ikke drepe M. tuberculosis, mens fiksering med alkohol er bakteriedrepende.
Dekk flekken
Flekken er dekket med carbol fuchsin-oppløsningen (primær grunnfarge).
Varm flekken
Dette gjøres i 5 minutter. Du bør merke en damputslipp (ca. 60 ° C). Det er viktig å ikke overopphetes og unngå å brenne prøven.
Med hensyn til oppvarmings av punktet må være meget forsiktig med å varme opp karbol fuchsin, særlig hvis fargingen utføres på et brett eller en annen beholder i hvilken det var samlet meget brannfarlige kjemikalier før farging.
Bare en liten flamme bør påføres under lysbildene ved hjelp av en opplyst serviet som tidligere er fuktet med noen dråper syrealkohol, metanol eller 70% etanol. Unngå å bruke en stor vatpinne gjennomvåt i etanol fordi dette er brannfare.
Vask flekken
Denne vasken skal gjøres med rent vann. Hvis vann fra springen ikke er rent, bør du smøre smøret med filtrert eller destillert vann, helst.
Dekk smøret med syrealkohol
Denne syrealkoholen bør være på 3%. Dekningen utføres i 5 minutter eller til smøret er tilstrekkelig misfarget, det vil si blekrosa.
Det må tas hensyn til at syrealkohol er brannfarlig; derfor må den brukes svært nøye. Unngå å være nær antennelseskilder.
Vask flekken
Vaskingen skal være med rent, destillert vann.
Dekk smøret med fargestoff
Det kan være grønn malakitt (0,5%) eller metylenblå (0,3%) fargestoff i 1 eller 2 minutter, med den lengste tiden hvis smeten er tynn.
Vask flekken
Rent vann må brukes igjen (destillert).
avløp
Baksiden av lysbildet skal rengjøres og flekken skal plasseres på en dreneringshylle slik at den lufttørkes (ikke bruk absorberende papir for tørking).
Undersøk smeden i mikroskopet
100X-målet og nedsenkingoljen skal brukes. Skann smøret systematisk og skriv ned de relevante observasjonene.
Tolk resultatene
Teoretisk sett er mikroorganismer som er farget en rødaktig farge betraktet som syrefaste positive (AAR +).
Tvert imot, hvis mikroorganismer er farget blå eller grønn, avhengig av fargestoffet som brukes som motfargestoff, betraktes de som negative alkoholresistente syre (AAR-).
referanser
- Apurba, S. & Sandhya, B. (2016). Essentials of Practical Microbiology (1. utgave). Jaypee Brothers Medical Publishers.
- Bauman, R. (2014). Mikrobiologi med sykdommer etter kroppssystem (4. ed.). Pearson Education, Inc.
- Heritage, J., Evans, E. & Killington, A. (1996). Introduktiv mikrobiologi (1. utgave). Cambridge University Press.
- Morello, J., Granato, P. Wilson, M. & Morton, V. (2006). Laboratoriehåndbok og arbeidsbok i mikrobiologi: Søknader til pasientbehandling (11. utgave). McGraw-Hill Education.
- Vasanthakumari, R. (2007). Lærebok for mikrobiologi (1. utgave). B.I. Publikasjoner PVT.


