Atom Modell av Bohr Egenskaper, Postulater, Begrensninger
den Bohrs atommodell er en representasjon av atomet foreslått av den danske fysikeren Neils Bohr (1885-1962). Modellen sier at elektronen beveger seg i baner med fast avstand rundt atomkjernen, og beskriver en jevn sirkulær bevegelse. Banene - eller energinivåene, som han kalte dem - har forskjellig energi.
Hver gang elektronen skifter bane, utsender den eller absorberer energi i faste mengder kalt "quanta". Bohr forklarte spekteret av lys utstrålet (eller absorbert) av hydrogenatomet. Når et elektron beveger seg fra en bane til en annen mot kjernen, er det et tap av energi og lys utstråles, med bølgelengde og energiegenskaper.

Bohr nummererte energinivåene til elektronen, i betraktning at jo nærmere elektronen er til kjernen, desto lavere er energitilstanden. På denne måten, jo lengre bort er elektronen fra kjernen, jo høyere blir energinivået og derfor blir energistaten høyere.
index
- 1 Hovedkarakteristikker
- 1.1 Det er basert på andre modeller og teorier om tiden
- 1.2 Eksperimentelle bevis
- 1.3 Elektroner finnes i energinivå
- 1.4 Uten energi er det ingen bevegelse av elektronen
- 1,5 Antall elektroner i hvert lag
- 1,6 Elektroner roterer i sirkulære baner uten utstråling av energi
- 1.7 Tillatte baner
- 1.8 Energi utgitt eller absorbert i hopp
- 2 Postulater av Bohr-atommodellen
- 2.1 Første postulat
- 2.2 andre postulat
- 2.3 Tredje postulat
- 3 Diagram over energinivåer for hydrogenatomer
- 4 De tre hovedbegrensningene til Bohr-modellen
- 5 Artikler av interesse
- 6 Referanser
Hovedkarakteristikker
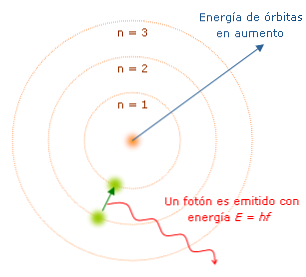
Bohr-modellegenskapene er viktige fordi de bestemte veien mot utviklingen av en mer komplett atommodell. De viktigste er:
Den er basert på andre modeller og teorier om tiden
Bohrs modell var den første til å innlemme kvanteteori støttet av Rutherfords atommodell og ideer tatt fra Albert Einsteins fotoelektriske effekt. Faktisk var Einstein og Bohr venner.
Eksperimentelle bevis
Ifølge denne modellen absorberer eller absorber atomerene bare stråling når elektronene hopper mellom de tillatte banene. Tyske fysikere James Franck og Gustav Hertz fikk eksperimentelt bevis på disse statene i 1914.
Elektroner finnes i energinivå
Elektroner omgir kjernen og eksisterer på bestemte energinivåer, som er diskrete og som er beskrevet i kvante tall.
Energiværdien av disse nivåene eksisterer som en funksjon av et tall n, kalt hovedkvantumstallet, som kan beregnes med ligninger som vil bli beskrevet senere.
Uten energi er det ingen bevegelse av elektronen
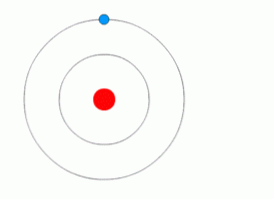
Illustrasjonen ovenfor viser et elektron som gjør kvantesprang.
Ifølge denne modellen, uten energi, er det ingen bevegelse av elektronen fra ett nivå til et annet, akkurat som uten energi, er det ikke mulig å løfte et objekt som har falt eller skilt to magneter.
Bohr foreslo kvantumet som energien som kreves av et elektron for å passere fra ett nivå til et annet. Han sa også at det laveste energinivået okkupert av et elektron kalles "bakken tilstand". Den "opphissede tilstanden" er en mer ustabil tilstand, som skyldes passasjen av et elektron til en høyere energibane.
Antall elektroner i hvert lag
Elektronene som passer inn i hvert lag beregnes med 2n2
De kjemiske elementene som er en del av det periodiske bordet og som er i samme kolonne, har de samme elektronene i det siste laget. Antall elekroner i de første fire lagene ville være 2, 8, 18 og 32.
Elektronene roterer i sirkulære baner uten utstråling av energi
Ifølge Bohrs første postulat beskriver elektroner sirkulære baner rundt atomkjernen uten å utstråle energi.
Orbits tillatt
Ifølge Bohrs andre postulat er de eneste tillatte banene for en elektron de som elektronens vinkelmoment L er et heltall flere av Planckkonstanten. Matematisk uttrykkes det slik:
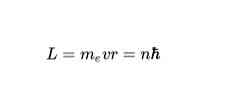
Energi utgitt eller absorbert i hopp
Ifølge det tredje postulatet ville elektronene sende eller absorbere energi i hopp fra en bane til en annen. I banehoppet blir en foton utstilt eller absorbert, hvis energi er representert matematisk:
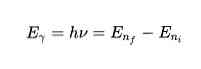
Postulater av Bohr-atommodellen
Bohr ga kontinuitet til atomets planetmodell, ifølge hvilken elektronene dreide rundt en positivt ladet kjerne, så vel som planeter rundt Sola.
Denne modellen utfordrer imidlertid en av postulatene i klassisk fysikk. I følge dette skal en partikkel med en elektrisk ladning (som elektronen) som beveger seg i en sirkulær bane, miste energi kontinuerlig ved utslipp av elektromagnetisk stråling. Når man mister energi, må elektronen følge en spiral til den faller i kjernen.
Bohr antok da at lovene i klassisk fysikk ikke var den mest egnede til å beskrive stabiliteten observert i atomer, og han presenterte følgende tre postulater:
Første postulat
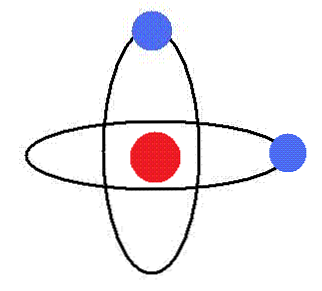
Elektronen spinner rundt kjernen i sirkelbaner uten utstråling av energi. I disse banjene er orbital vinkelmomentet konstant.
For elektroner av et atom tillates bare baner av bestemte radii, som svarer til bestemte definerte energinivåer.
Andre postulat
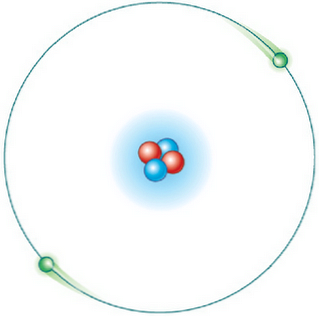
Ikke alle baner er mulige. Men når elektronen er i en bane som er tillatt, er den i en tilstand av spesifikk og konstant energi og gir ikke energi (stasjonær energibane).
For eksempel i hydrogenatomet er de tillatte energiene for elektronen gitt av følgende ligning:
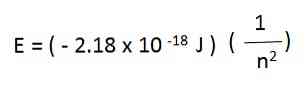
Elektronenergiene til et hydrogenatom som er generert fra ovennevnte ligning er negative for hver av verdiene av n. Når n øker, er energien mindre negativ og øker derfor.
Når n er stor nok, for eksempel, n = ∞-energien er null og representerer at elektronen har blitt frigjort og det ioniserte atom. Denne tilstanden med null energi har større energi enn stater med negative energier.
Tredje postulat
Et elektron kan skifte fra en stasjonær energibane til en annen ved å sende ut eller absorbere energi.
Energien som sendes ut eller absorberes, vil være lik energiforskjellen mellom de to tilstandene. Denne energien E er i form av en foton og er gitt ved følgende ligning:
E = h ν
I denne ligningen er E energien (absorbert eller utsendt), h er Planck konstanten (dens verdi er 6,63 x 10-34 Joule-sekunder [J-s]) og v er lysfrekvensen, hvis enhet er 1 / s.
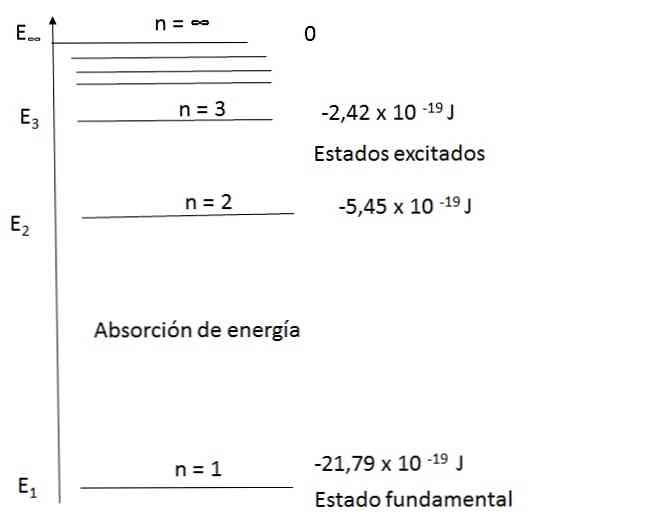
Diagram over energinivåer for hydrogenatomer
Bohr-modellen kunne tilfredsstillende forklare spektret av hydrogenatomet. For eksempel, i området av bølgelengder av synlig lys, er utslippsspektret for hydrogenatomet som følger:
La oss se hvordan du kan beregne frekvensen til noen av de observerte lysbåndene; for eksempel fargen rød.
Ved å bruke den første ligningen og erstatte n for 2 og 3 får du resultatene som vises i diagrammet.

Det er:
For n = 2, E2 = -5,45 x 10-19 J
For n = 3, E3 = -2,42 x 10-19 J
Det er da mulig å beregne energiforskjellen for de to nivåene:
ΔE = E3 - E2 = (-2,42 - (- 5,45)) x 10 - 19 = 3,43 x 10 - 19 J
I følge ligningen forklart i det tredje postulatet ΔE = h v. Deretter kan du beregne v (lysfrekvens):
v = ΔE / h
Det er:
v = 3,43 x 10-19 J / 6,63 x 10-34 J-s
v = 4,56 x 1014 s-1 eller 4,56 x 1014 hz
Å være λ = c / v, og lysets hastighet c = 3 x 10 8 m / s, bølgelengden er gitt av:
A = 6,565 x 10 - 7 m (656,5 nm)
Dette er bølgelengdeverdien til det røde båndet som observeres i spektret av hydrogenlinjer.
De tre hovedbegrensningene til Bohr-modellen
1- Det tilpasser seg til hydrogenatomspektret, men ikke til spektrene til andre atomer.
2- Elektronens bølgende egenskaper er ikke representert i beskrivelsen av dette som en liten partikkel som dreier seg rundt atomkjernen.
3- Bohr unnlater å forklare hvorfor klassisk elektromagnetisme ikke gjelder for modellen. Det er derfor at elektroner ikke avgir elektromagnetisk stråling når de er i en stasjonær bane.
Artikler av interesse
Atommodell av Schrödinger.
Atommodell av Broglie.
Atommodell av Chadwick.
Atommodell av Heisenberg.
Atommodell av Perrin.
Atommodell av Thomson.
Atommodell av Dalton.
Atomisk modell av Dirac Jordan.
Atomisk modell av Democritus.
referanser
- Brown, T. L. (2008). Kjemi: den sentrale vitenskapen. Upper Saddle River, NJ: Pearson Prentice Hall
- Eisberg, R., & Resnick, R. (2009). Kvantumfysikk av atomer, molekyler, faste stoffer, kjerner og partikler. New York: Wiley
- Atommodell av Bohr-Sommerfeld. Hentet fra: fisquiweb.es
- Joesten, M. (1991). Verden av kjemi Philadelphia, Pa.: Saunders College Publishing, s. 76-78.
- Modèle de Bohr de l'atom d'hydrogène. Hentet fra fr.khanacademy.org
- Izlar, K. Retrospective sur l'atom: Le modèle de Bohr en cent ans. Hentet fra: home.cern



