Picronsyrestruktur, syntese, egenskaper og anvendelser
den pikrinsyre er en høyt nitrert organisk kjemisk forbindelse hvis navn IUPAC er 2,4,6-trinitrofenol. Dens molekylære formel er C6H2(NO2)3OH. Det er en veldig sur fenol, og kan finnes som natrium-, ammonium- eller kaliumpikrat; det vil si i sin ioniske form C6H2(NO2)3ONa.
Det er en solid av en sterk smak av bitter, og derfra kommer navnet sitt, fra det greske ordet "prikos", som betyr bittert. Det er funnet som våte gule krystaller. Tørking eller dehydrering er farlig, da det øker de ustabile egenskapene som gjør det eksplosivt.
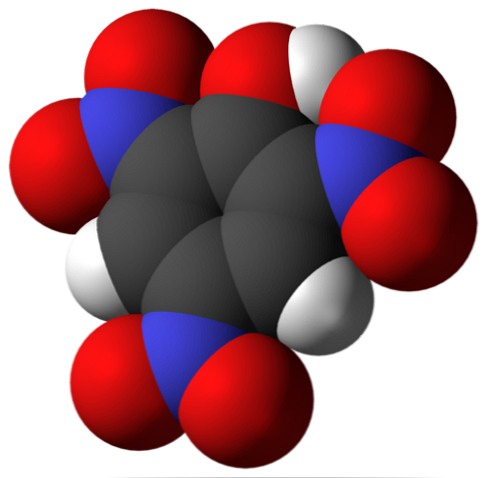
Over er pikrinsyremolekylet. På bildet er det vanskelig å gjenkjenne bindingene og atomer fordi dette tilsvarer representasjonen av Van der Waals-overflaten. Den molekylære strukturen er nærmere omtalt i neste avsnitt.
Noen intermediære forbindelser, forskjellige pikratesalter og pikrinsyrekomplekser syntetiseres fra pikrinsyre..
Picronsyre brukes som en base for syntese av gulfarvede permanente fargestoffer. Noen patologer og forskere bruker det i fiksering eller farging av vevseksjoner og andre immunhistokjemiske prosesser.
Det er meget nyttig i fremstillingen av farmasøytiske produkter. I tillegg brukes den til produksjon av kamper eller kamper og eksplosiver. Det brukes også til å grave metaller, å lage farget glass, og i kolorimetrisk bestemmelse av biologiske parametere som kreatinin.
På den annen side er pikrinsyre irriterende når det kommer i kontakt med huden, med luftveiene, okulær og fordøyelsesslimt. I tillegg til å skade huden, kan det påvirke nyrene, blodet og leveren, blant annet andre organer.
index
- 1 struktur
- 1.1 Syr fenol
- 1.2 Krystallstruktur
- 2 Sammendrag
- 2.1 Direkte nitrering av fenol
- 3 Fysiske og kjemiske egenskaper
- 3.1 Molekylvekt
- 3.2 Fysisk utseende
- 3,3 lukt
- 3.4 Smak
- 3,5 smeltepunkt
- 3.6 kokepunkt
- 3,7 tetthet
- 3.8 Løselighet
- 3.9 Korrosivitet
- 3,10 pKa
- 3.11 Ustabilitet
- 4 bruksområder
- 4.1 Forskning
- 4.2 Organisk kjemi
- 4.3 I industrien
- 4.4 Militære applikasjoner
- 5 Toksisitet
- 6 Referanser
struktur

I det øvre bildet er alle koblingene og selve strukturen av pikrinsyremolekylet vist mer detaljert. Den består av en fenol med tre nitro substituenter.
Det kan ses det i NO-gruppene2 nitrogenatomet har en positiv partiell ladning, og krever derfor elektronisk tetthet av omgivelsene. Men den aromatiske ringen tiltrekker også elektronene til seg selv, og før de tre NO2 det ender opp med å gi opp en del av sin egen elektroniske tetthet.
Som et resultat av dette har oksygen av OH-gruppen en tendens til å dele en av sine elektroniske par for å levere den elektroniske mangelen som ringen forårsaker. og dermed blir C = O-lenken dannet+-H. Denne partielle delbelastningen på oksygen svekker O-H-bindingen og øker surheten. det vil si det vil bli frigjort som hydrogen ion, H+.
Syr fenol
Det er av denne grunn at denne forbindelsen er en eksepsjonelt sterk (og reaktiv) syre, enda mer enn eddiksyre i seg selv. Imidlertid er forbindelsen egentlig en fenol hvis surhet overgår de andre fenoler; på grunn av, som nevnt, til NO-substituenter2.
Derfor, som det er en fenol, har OH-gruppen prioritet og styrer oppregningen i strukturen. De tre nei2 De er lokalisert i karboner 2, 4 og 6 av den aromatiske ringen med hensyn til OH. Derfor er IUPAC-nomenklaturen for denne forbindelsen: 2,4,6-Trinitrofenol (TNP, for sin akronym på engelsk).
Hvis gruppene ikke var2, eller hvis det var et mindre antall av dem i ringen, ville O-H-bindingen svekke mindre, og derfor ville forbindelsen ha lavere surhet.
Krystallstruktur
Molekylene av pikrinsyre er anordnet på en slik måte at de favoriserer deres intermolekylære interaksjoner; enten for dannelse av hydrogenbroer mellom OH og NO-grupper2, dipol-dipol-krefter eller elektrostatiske frastøtninger mellom mangelfulle områder av elektroner.
Det kan forventes at gruppene ikke gjør det2 de avstøtet hverandre og ville være orientert mot de nærliggende aromatiske ringene. Også ringene kunne ikke justeres på toppen av hverandre ved en økning i elektrostatiske frastøtninger.
Produkt av alle disse interaksjonene, klarer pikrinsyren å danne et tredimensjonalt nettverk som definerer en krystall; hvis enhetscelle tilsvarer et krystallsystem av den ortorombiske typen.
syntese
I utgangspunktet ble det syntetisert fra naturlige forbindelser som blant annet animalsk hornderivater, naturlige harpikser. Siden 1841 har fenol blitt brukt som forløper for pikrinsyre, etter flere ruter eller gjennom ulike kjemiske prosedyrer.
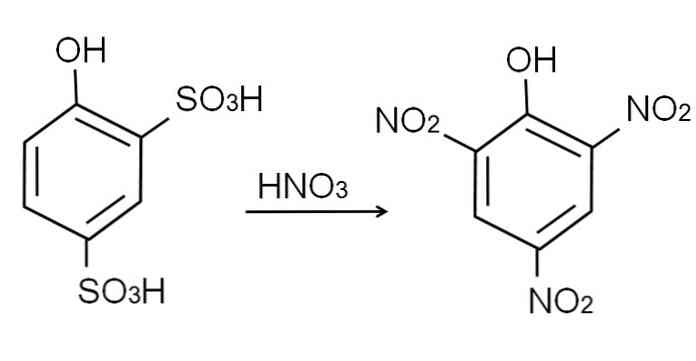
Som sagt er det en av de mest sure fenolene. For å syntetisere det, er det først påkrevet at fenolen gjennomgår en sulfoneringsprosess, etterfulgt av en nitreringsprosedyre.
Sulfonering av vannfri fenol utføres ved behandling av fenol med svovelsyre, med aromatiske elektrofile substitusjoner av H ved sulfonatgrupper, S023H, i stillingen og for OH-gruppen.
Til dette produktet, 2,4-fenoldisulfonsyre, utføres nitreringsprosessen og behandles med konsentrert salpetersyre. Ved å gjøre det, de to SO-gruppene3H er erstattet av nitrogruppene, NO2, og en tredjedel går inn i den andre nitroposisjonen. Følgende kjemiske ligning illustrerer dette:
Direkte nitrering av fenol
Nitreringsprosessen av fenol kan ikke utføres direkte, da tars av høy molekylvekt frembringes. Denne syntesemetoden krever en meget nøye kontroll av temperaturen, siden den er svært eksoterm:
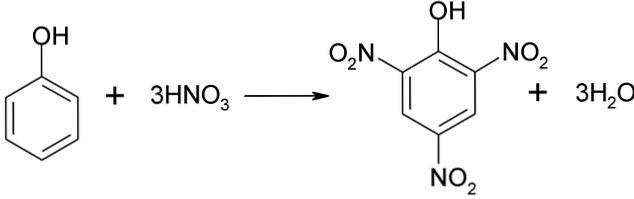
Picronsyre kan oppnås ved å utføre den direkte nitreringsprosessen av 2,4-dinitrofenol, med salpetersyre.
En annen form for syntese er å behandle benzen med salpetersyre og kvikksølvnitrat.
Fysiske og kjemiske egenskaper
Molekylvekt
229,104 g / mol.
Fysisk utseende
Masse eller gul suspensjon av våte krystaller.
lukt
Det er luktfritt.
smaken
Det er veldig bittert.
Smeltepunkt
122,5 ° C.
Kokepunkt
300 ° C Men når den smelter, eksploderer den.
tetthet
1,77 g / ml.
løselighet
Det er en sammensatt, moderat løselig i vann. Dette skyldes at deres OH- og NO-grupper2 de kan samhandle med vannmolekyler gjennom hydrogenbindinger; selv om den aromatiske ringen er hydrofob, og derfor er dens oppløselighet svekket.
etse
Picronsyre er generelt etsende for metaller, bortsett fra tinn og aluminium.
pKa
0,38. Det er en sterk organisk syre.
ustøhet
Picronsyre er preget av sine ustabile egenskaper. Det utgjør en risiko for miljøet, den er ustabil, eksplosiv og giftig.
Det bør oppbevares tett lukket for å unngå dehydrering, da pikrinsyre er svært eksplosiv hvis den får tørke. Man må være veldig forsiktig med sin vannfrie form, fordi den er svært følsom for friksjon, støt og varme.
Picronsyre bør oppbevares på ventilert, kjølig sted, borte fra oksiderbare materialer. Det er irriterende for hud og slimhinner, bør ikke svelges og er giftig for kroppen.
søknader
Picronsyre har vært mye brukt i forskning, kjemi, industri og militær.
forskning
Når det brukes som et fikseringsmiddel av celler og vev, forbedrer det resultatene av fargekvaliteten av disse med sure fargestoffer. Det skjer med trikromfargemetoder. Etter å ha festet vevet med formalin, anbefales en ny fiksering med pikrinsyre.
På den måten garanteres en intens og veldig lys fargestoff av vevet. Gode resultater oppnås ikke med grunnleggende fargestoffer. Imidlertid bør det tas forholdsregler, da pikrinsyre kan hydrolyse DNA hvis for mye tid er igjen.
Organisk kjemi
-I organisk kjemi brukes den som alkaliske pikrates til å utføre identifikasjon og analyse av ulike stoffer.
-Det brukes i metallets analytiske kjemi.
-I kliniske laboratorier brukes det til bestemmelse av serum og urin kreatininnivå.
-Det har også vært brukt i noen av reagensene som brukes til analyse av glukose nivåer.
I bransjen
-På nivået med den fotografiske industrien har piktinsyre blitt brukt som en følsomhet i fotografiske emulsjoner. Det har vært en del av utviklingen av produkter som pesticider, sterke insektmidler, blant annet.
-Picronsyre brukes til å syntetisere andre intermediære kjemiske forbindelser, for eksempel klorpikrin og pikraminsyre. Noen stoffer og fargestoffer for lærindustrien er utviklet fra disse forbindelsene.
-Picronsyre ble brukt til behandling av forbrenninger, som en antiseptisk og andre forhold, før toksisiteten ble påvist.
-Viktig komponent på grunn av sin eksplosive natur ved produksjon av kamper og batterier.
Militære applikasjoner
-På grunn av den høye eksplosiviteten av pikrinsyre, har den blitt brukt i militære våpenammunasjonsanlegg.
-Presset og smeltet piktinsyre har blitt brukt i artilleri skaller, granater, bomber og gruver.
-Ammoniumsaltet av pikrinsyre har blitt brukt som et eksplosivt, det er veldig kraftig, men mindre stabilt enn TNT. For en tid ble den brukt som en komponent av rakettbrennstoffet.
toksisitet
Det har vist seg å være svært giftig for menneskekroppen og generelt for alle levende vesener.
Det anbefales å unngå innånding og inntak på grunn av sin akutte oral toksisitet. Det forårsaker også mutasjon i mikroorganismer. Presenterer toksiske effekter på dyreliv, pattedyr og generelt i miljøet.
referanser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Aminer. (10th utgaven.). Wiley Plus.
- Carey F. (2008). Organisk kjemi (Sjette utgave). Mc Graw Hill.
- Wikipedia. (2018). Picronsyre. Hentet fra: en.wikipedia.org
- Purdue University. (2004). Picronsyreeksplosjon. Hentet fra: chemed.chem.purdue.edu
- Krystallografi 365 prosjekt. (10. februar 2014). Mindre enn mild gul - strukturen av pikrinsyre. Hentet fra: crystallography365.wordpress.com
- Pubchem. (2019). Picronsyre Hentet fra: pubchem.ncbi.nlm.nih.gov
- Baker, J.R. (1958). Picronsyre Methuen, London, Storbritannia.


